In analogia a quanto visto per le misure potenziometriche, si distingue fra conduttimetria diretta e indiretta.
Nel caso della conduttimetria diretta, ha interesse il valore effettivo della conducibilita' specifica di una soluzione, che quindi va determinata il piu' accuratamente possibile. A tale scopo, deve essere nota con la massima precisione la costante della cella impiegata per poter risalire dalla conducibilita' misurata alla conducibilita' specifica (equazione (3.4))
La costante di cella viene determinata misurando la conducibilita' di
soluzioni a conducibilita' specifica nota: si impiegano ad esempio
soluzioni di ![]() , la cui conducibilita' specifica e' nota con grande
accuratezza per diversi valori di concentrazione e temperatura. Fra le
applicazioni della conduttimetria diretta si puo' citare il controllo
della purezza dell'acqua, intesa come verifica dell'assenza di
elettroliti disciolti: la conducibilita' specifica dell'acqua
ultrapura e' pari a
, la cui conducibilita' specifica e' nota con grande
accuratezza per diversi valori di concentrazione e temperatura. Fra le
applicazioni della conduttimetria diretta si puo' citare il controllo
della purezza dell'acqua, intesa come verifica dell'assenza di
elettroliti disciolti: la conducibilita' specifica dell'acqua
ultrapura e' pari a
![]() .
.
Nelle misure conduttimetriche indirette, cio' che conta e' la variazione di conducibilita', piu' che il suo valore effettivo: non ha dunque molta importanza conoscere esattamente la costante di cella.
Un esempio classico di conduttimetria indiretta e' costituito dalle titolazioni conduttimetriche, in cui la conducibilita' della soluzione da titolare viene misurata in funzione del volume di titolante aggiunto.
A diluizione finita, per l'elettrolita ![]() esimo di una soluzione si
puo' scrivere, approssimativamente:3.1
esimo di una soluzione si
puo' scrivere, approssimativamente:3.1
D'altro canto (equazione (3.5)):
Combinando le equazioni (3.24) e (3.25):
Si vede quindi che la conducibilita' di una soluzione dipende linearmente dalle concentrazioni ioniche e puo' pertanto essere sfruttata per seguire il corso di una titolazione durante la quale tali concentrazioni subiscano delle variazioni.
Un caso tipico e' quello delle titolazioni acido-base, in cui si hanno
grosse variazioni della concentrazione di ioni ![]() e
e
![]() : come si e' avuto modo di accennare, tali ioni possiedono
una conducibilita' individuale molto maggiore di quella della maggior
parte degli altri ioni e quindi la variazione della loro
concentrazione nel corso della titolazione produrra' grosse variazioni
nella conducibilita' globale della soluzione
(equazione (3.26)).
: come si e' avuto modo di accennare, tali ioni possiedono
una conducibilita' individuale molto maggiore di quella della maggior
parte degli altri ioni e quindi la variazione della loro
concentrazione nel corso della titolazione produrra' grosse variazioni
nella conducibilita' globale della soluzione
(equazione (3.26)).
Nel corso di una titolazione, le concentrazioni delle specie ioniche
variano per effetto della reazione analitica, ma anche a causa della
diluizione dovuta all'aggiunta della soluzione titolante. Al fine di
limitare quest'ultimo effetto, si cerca generalmente di condurre la
titolazione su un volume di soluzione molto elevato (![]() ),
con una soluzione titolante molto concentrata (
),
con una soluzione titolante molto concentrata (![]() ), in modo che
l'aumento di volume dovuto all'aggiunta del titolante sia
trascurabile.
), in modo che
l'aumento di volume dovuto all'aggiunta del titolante sia
trascurabile.
Analizziamo di seguito alcuni esempi di curve di titolazione conduttimetrica.
Come detto in precedenza, lo ione idrogeno e lo ione ossidrile hanno conducibilita' individuali molto elevate (tabella 3.1). Le elevate variazioni che subiscono le concentrazioni di questi due ioni nel corso di una titolazione acido base determinano corrispondenti variazioni nella conducibilita' della soluzione, la cui misura puo' quindi essere utilmente impiegata per seguire il corso della titolazione.
La curva di titolazione e' mostrata in figura 3.8 e potrebbe
riferirsi, ad esempio, ad una titolazione di ![]() con soluzione
standard di
con soluzione
standard di ![]() . Come si puo' vedere, la curva e' costituita da due
rami lineari che si intersecano in corrispondenza al punto finale.
. Come si puo' vedere, la curva e' costituita da due
rami lineari che si intersecano in corrispondenza al punto finale.
La conducibilita' della soluzione e' data da:
Il calo di conducibilita' proporzionale alla quantita' di titolante
aggiunta che si osserva prima del punto finale si spiega col fatto
che in questa fase della titolazione, l'aggiunta di ![]() produce
come effetto globale la sostituzione di ioni
produce
come effetto globale la sostituzione di ioni ![]() ad elevata
conducibilita' con ioni
ad elevata
conducibilita' con ioni ![]() a conducibilita' inferiore secondo:
a conducibilita' inferiore secondo:
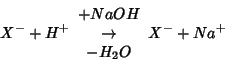
Una volta superato il punto finale, la conducibilita' ricomincia a
crescere linearmente con la quantita' di titolante aggiunto a causa
dell'eccesso di ![]() .
.
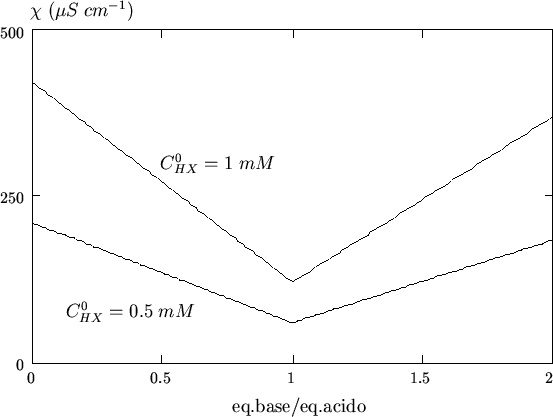 |
Va osservato che la curva di figura 3.8 si ottiene solo se il volume di soluzione titolante aggiunto e' trascurabile rispetto a quello della soluzione da titolare: solo in questa ipotesi, infatti, le variazioni di concentrazione dovute alla reazione di neutralizzazione sono linearmente dipendenti dal volume di soluzione titolante.
Indicando con ![]() la concentrazione iniziale di
la concentrazione iniziale di ![]() ,
con
,
con ![]() la concentrazione della soluzione titolante, con
la concentrazione della soluzione titolante, con
![]() il volume di soluzione titolante aggiunto e con
il volume di soluzione titolante aggiunto e con ![]() quello
iniziale della soluzione da titolare, prima del punto finale si ha:
quello
iniziale della soluzione da titolare, prima del punto finale si ha:
![\begin{eqnarray*}
{[}H^+{]}&=&C^\circ_{HCl}-\frac{VC_{NaOH}}{V^0+V}\\
{[}Na^+{]}&=&\frac{VC_{NaOH}}{V^0+V}\\
\end{eqnarray*}](img685.gif)
e dopo il punto finale si ha:
![\begin{eqnarray*}
{[}Na^+{]}&=&\frac{VC_{NaOH}}{V^0+V}\\
{[}OH^-{]}&=&\frac{VC_{NaOH}-V^0C^\circ_{HCl}}{V^0+V}\\
\end{eqnarray*}](img686.gif)
Appare dunque evidente che le relazioni su scritte sono lineari
rispetto a ![]() solo se
solo se ![]() .
.
L'effetto della diluizione e' illustrato nella figura 3.9.
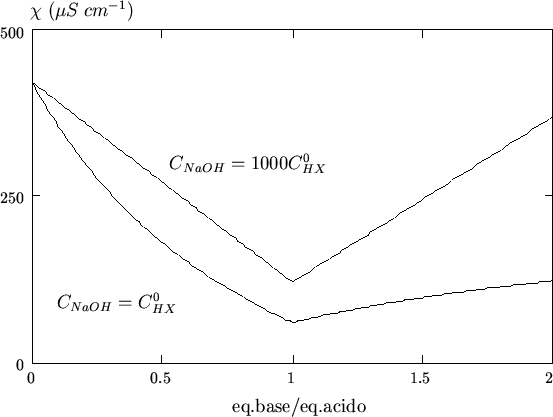 |
Al diminuire della costante di ionizzazione dell'acido, il tratto di curva precedente il punto finale della titolazione si modifica come illustrato in figura 3.10, mentre il tratto di curva successivo al punto finale resta invariato.
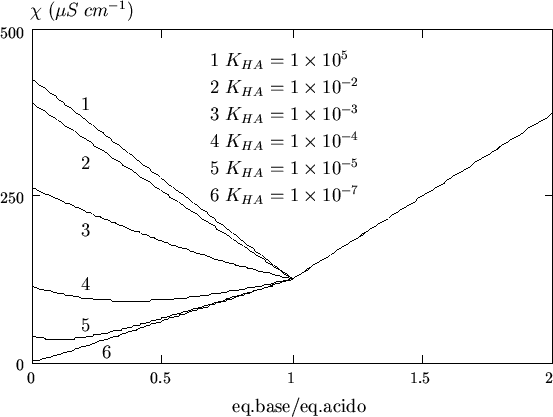 |
La curva n. 4 in figura 3.10 si riferisce alla
titolazione di un acido mediamente debole con ![]() ed e' riportata
in figura 3.11 per comodita'.
ed e' riportata
in figura 3.11 per comodita'.
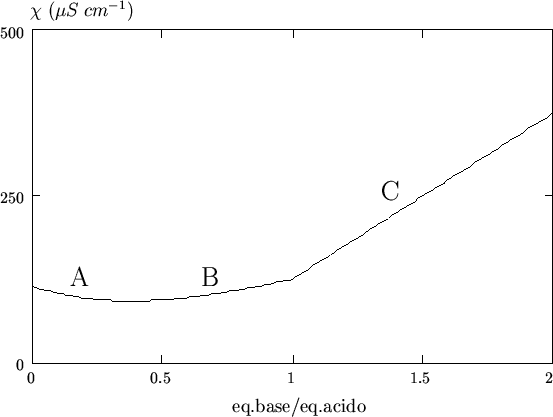 |
La curva presenta tre regioni distinte, indicate con le lettere A B e
C. Nella prima fase della titolazione (tratto A), si ha un calo di
conducibilita' dovuto al fatto che l'aggiunta di base ha come effetto
la sostituzione dei (pochi) ioni ![]() liberi con ioni
liberi con ioni ![]() a conducibilita' individuale minore (si noti che l'ulteriore
dissociazione dell'acido debole e' repressa dalla presenza dell'anione
libero).
a conducibilita' individuale minore (si noti che l'ulteriore
dissociazione dell'acido debole e' repressa dalla presenza dell'anione
libero).
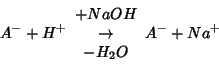
Un'ulteriore aggiunta di base provoca un aumento di conducibilita' (tratto B): in tali condizioni, infatti, la base reagisce direttamente con l'acido indissociato:
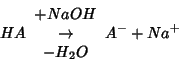
provocando percio' un aumento della concentrazione totale di specie
ioniche (il consumo degli ioni ![]() liberi gioca un ruolo
secondario a causa della concentrazione sempre maggiore di anione
libero).
liberi gioca un ruolo
secondario a causa della concentrazione sempre maggiore di anione
libero).
Dopo il punto finale (tratto C), si osserva un netto incremento di
conducibilita' dovuto all'eccesso di base (in particolare di ioni
![]() liberi).
liberi).
Va osservato che in corrispondenza al punto finale la curva di titolazione sperimentale presenta un caratteristico arrotondamento che e' da attribuirsi a fenomeni di idrolisi piu' o meno accentuati.
Dalla figura 3.11 si vede che la determinazione del punto finale, che si ottiene dall'intersezione dei tratti B e C della curva, puo' presentare qualche difficolta'.
Un utile espediente al proposito e' quello di usare come titolante una
base debole (ad esempio ![]() ). In tal caso, l'andamento della
curva prima del punto finale rimane praticamente invariato, perche' la
costante della reazione acido-base e' comunque elevata (essa e' data
da
). In tal caso, l'andamento della
curva prima del punto finale rimane praticamente invariato, perche' la
costante della reazione acido-base e' comunque elevata (essa e' data
da
![]() , dove
, dove ![]() e' la costante di
dissociazione dell'acido,
e' la costante di
dissociazione dell'acido, ![]() quella della base e
quella della base e ![]() e' il
prodotto ionico dell'acqua). Dopo il punto finale, l'eccesso del
catione della base formato nella prima parte della titolazione (ione
e' il
prodotto ionico dell'acqua). Dopo il punto finale, l'eccesso del
catione della base formato nella prima parte della titolazione (ione
![]() se si usa
se si usa ![]() ) reprime l'equilibrio di
ionizzazione della base in eccesso per cui la conducibilita' della
soluzione rimane costante. Il risultato e' mostrato in figura
3.12, da cui il vantaggio nella determinazione del
punto finale dovrebbe risultare evidente.
) reprime l'equilibrio di
ionizzazione della base in eccesso per cui la conducibilita' della
soluzione rimane costante. Il risultato e' mostrato in figura
3.12, da cui il vantaggio nella determinazione del
punto finale dovrebbe risultare evidente.
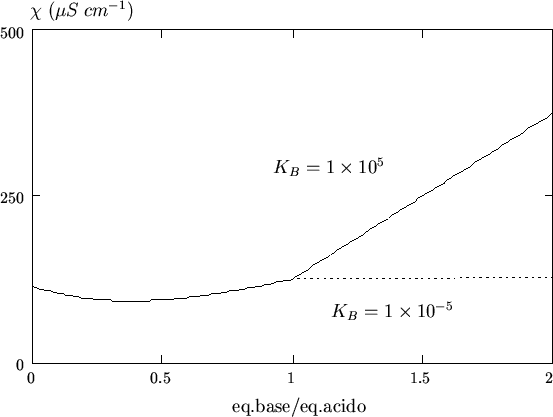 |
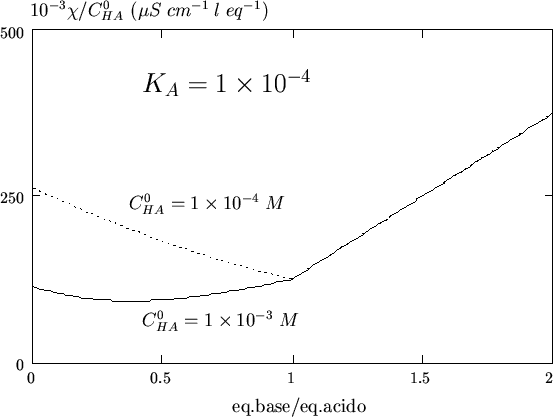
Un altro accorgimento che facilita la determinazione del punto finale
per queste titolazioni e' quello di diluire la soluzione contenente
l'acido da titolare. A concentrazione minore il grado di
dissociazione dell'acido debole e' maggiore: la concentrazione di ioni
![]() liberi e' maggiore e quindi la conducibilita' iniziale della
soluzione e' piu' elevata ( relativamente a quella corrispondente
al punto di equivalenza). L'effetto e' quello di rendere piu' acuto
l'angolo tra il tratto di curva precedente e quello successivo al
punto finale, ed e' illustrato nella figura 3.13,
dove, per comodita' di confronto, la conducibilita' e' stata
normalizzata rispetto alla concentrazione iniziale di acido.
liberi e' maggiore e quindi la conducibilita' iniziale della
soluzione e' piu' elevata ( relativamente a quella corrispondente
al punto di equivalenza). L'effetto e' quello di rendere piu' acuto
l'angolo tra il tratto di curva precedente e quello successivo al
punto finale, ed e' illustrato nella figura 3.13,
dove, per comodita' di confronto, la conducibilita' e' stata
normalizzata rispetto alla concentrazione iniziale di acido.
 |
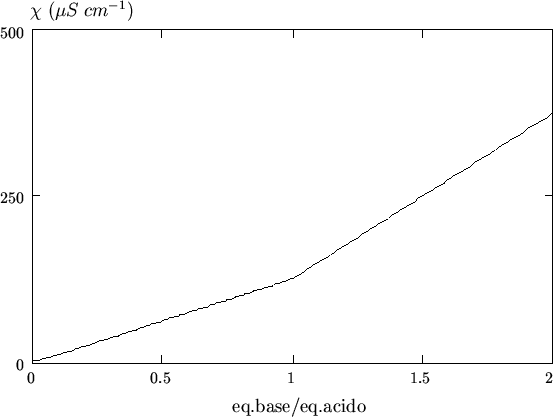
La curva n. 6 in figura 3.10 si riferisce alla
titolazione di un acido molto debole con una base forte
(es. ![]() ) ed e' riportata in figura 3.14 per comodita'.
) ed e' riportata in figura 3.14 per comodita'.
Si considera molto debole un acido con ![]() compreso fra
compreso fra ![]() e
e ![]() .
.
Come si vede, nella curva di titolazione manca il pattern ``a minimo''
che si era visto per gli acidi moderatamente deboli. Cio' e' dovuto al
fatto che in questo caso la concentrazione di ioni ![]() liberi e'
trascurabile.
liberi e'
trascurabile.
 |
La determinazione del punto finale puo' essere resa piu' agevole
aggiungendo alla soluzione dell'acido un eccesso di una base debole
(ad esempio ![]() ) prima di titolare con una base forte. Infatti,
l'aggiunta della base debole provoca una completa salificazione
dell'acido:
) prima di titolare con una base forte. Infatti,
l'aggiunta della base debole provoca una completa salificazione
dell'acido:
La base forte titola percio' lo ione ammonio formato:
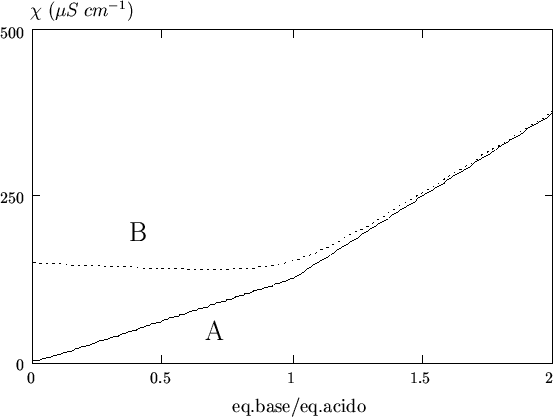
Come si vede, prima del punto finale l'effetto globale consiste nella
sostituzione di ioni ![]() (
(
![]() ) con ioni
) con ioni ![]() (
(
![]() ), con conseguente
diminuzione della conducibilita'. Dopo il punto finale si ha
ovviamente un incremento di conducibilita' dovuto all'eccesso di base
forte. Questo effetto e' illustrato nella figura 3.15.
), con conseguente
diminuzione della conducibilita'. Dopo il punto finale si ha
ovviamente un incremento di conducibilita' dovuto all'eccesso di base
forte. Questo effetto e' illustrato nella figura 3.15.
 |