La misura della conducibilita' di una soluzione puo' essere utilizzata per la determinazione del punto finale di una titolazione di precipitazione.
Un esempio tipico e' quello della titolazione di una soluzione di ![]() con una soluzione di
con una soluzione di ![]() : la curva di titolazione
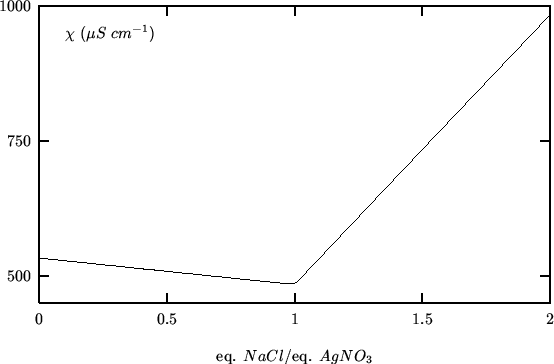
risultante e' mostrata nella figura 3.16.
: la curva di titolazione
risultante e' mostrata nella figura 3.16.
 |
Dopo ogni aggiunta della soluzione di ![]() , la conducibilita'
specifica della soluzione in
, la conducibilita'
specifica della soluzione in ![]() e' data da:
e' data da:
Assumendo che la soluzione sia neutra e che la titolazione non alteri il
![]() si ha:
si ha:
Inoltre, assumendo che la precipitazione di ![]() sia completa, prima
del punto finale si ha:
sia completa, prima
del punto finale si ha:
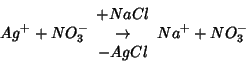
Quindi, l'effetto dell'aggiunta di ![]() e' quello di
sostituire ioni
e' quello di
sostituire ioni ![]() (
(
![]() ) con ioni
) con ioni
![]() (
(
![]() ):
questo spiega il calo di conducibilita' che si osserva prima del punto
finale.
):
questo spiega il calo di conducibilita' che si osserva prima del punto
finale.
Dopo il punto finale la conducibilita' cresce a causa dell'eccesso di
![]() .
.
La solubilita' del sale poco solubile che si forma (in questo esempio
![]() ) ha come effetto uno smussamento della curva di titolazione in
corrispondenza al punto finale. Tale inconveniente, tuttavia, e'
facilmente superabile estrapolando i due tratti di curva lineari prima e
dopo il punto finale.
) ha come effetto uno smussamento della curva di titolazione in
corrispondenza al punto finale. Tale inconveniente, tuttavia, e'
facilmente superabile estrapolando i due tratti di curva lineari prima e
dopo il punto finale.