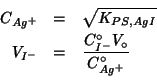
avendo indicato con ![]() il volume di soluzione titolante
al punto di equivalenza per gli ioni
il volume di soluzione titolante
al punto di equivalenza per gli ioni ![]() .
.
In queste condizioni, per quanto riguarda l'equilibrio di
precipitazione di ![]() , si ha:
, si ha:
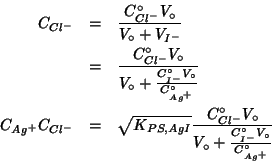
Si puo' facilmente constatare che, per valori tipici dei parametri
usati nelle esperienze di laboratorio (es.
![]() )
si ha:
)
si ha:
![]() , il che significa
che
, il che significa
che ![]() inizia a precipitare prima che sia raggiunto il
punto di equivalenza per gli ioni
inizia a precipitare prima che sia raggiunto il
punto di equivalenza per gli ioni ![]() .
.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .