Lo ftalato acido di potassio viene titolato con una soluzione standard
di ![]() e le variazioni di
e le variazioni di ![]() che si hanno nel corso della
titolazione possono essere convenientemente seguite per via
potenziometrica, impiegando un elettrodo a vetro come elettrodo
indicatore. La procedura sperimentale e' identica a quella generale
per le titolazioni potenziometriche precedentemente esposta.
che si hanno nel corso della
titolazione possono essere convenientemente seguite per via
potenziometrica, impiegando un elettrodo a vetro come elettrodo
indicatore. La procedura sperimentale e' identica a quella generale
per le titolazioni potenziometriche precedentemente esposta.
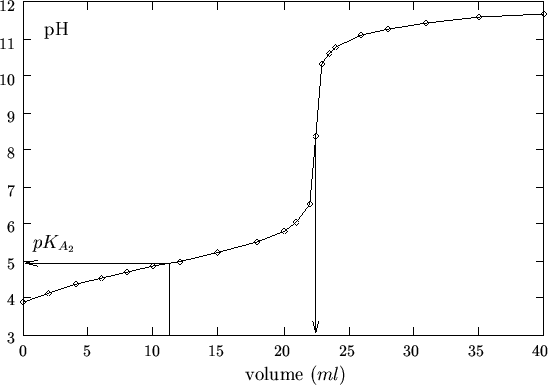
Al termine dell'esperienza viene costruita la curva di titolazione
riportando il ![]() in funzione del volume di soluzione di
in funzione del volume di soluzione di ![]() aggiunto (figura 1.19); il punto finale viene
determinato con uno dei metodi discussi; inoltre, dal punto di
semiequivalenza (cioe' dal volume di titolante corrispondente a meta'
del volume finale) si puo' risalire, graficamente o per altra via, al
aggiunto (figura 1.19); il punto finale viene
determinato con uno dei metodi discussi; inoltre, dal punto di
semiequivalenza (cioe' dal volume di titolante corrispondente a meta'
del volume finale) si puo' risalire, graficamente o per altra via, al
![]() dell'acido.
dell'acido.
In tali condizioni si ha infatti:
e quindi:
Il calcolo della curva di titolazione di un acido debole con una base forte e' illustrato nell'Appendice A.
 |
L'acido maleico viene titolato con soluzione standard di ![]() secondo:
secondo:
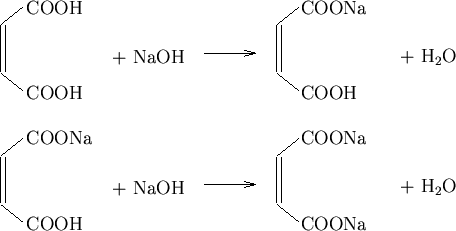
e il corso della titolazione puo' essere seguito per via potenziometrica utilizzando un elettrodo a vetro come elettrodo indicatore. La procedura sperimentale e' identica a quella generale per le titolazioni potenziometriche precedentemente esposta.
Al termine dell'esperienza viene costruita la curva di titolazione
riportando il ![]() in funzione del volume di soluzione di
in funzione del volume di soluzione di ![]() aggiunto (figura 1.20); il punto finale viene
determinato piu' agevolmente in corrispondenza al secondo flesso della
curva, che risulta piu' netto.
aggiunto (figura 1.20); il punto finale viene
determinato piu' agevolmente in corrispondenza al secondo flesso della
curva, che risulta piu' netto.
Gli alogenuri d'argento sono sali poco solubili e cio' consente il
dosaggio degli alogenuri mediante titolazione con soluzione standard
di ![]() .
.
Quando ad una soluzione contenente un alogenuro ![]() si aggiunge una
soluzione di
si aggiunge una
soluzione di ![]() , avviene la seguente reazione:
, avviene la seguente reazione:
Siccome ![]() e' un sale poco solubile, la reazione di
precipitazione su scritta e' molto spostata verso destra. Cio'
significa che, fino a che la soluzione contiene ioni
e' un sale poco solubile, la reazione di
precipitazione su scritta e' molto spostata verso destra. Cio'
significa che, fino a che la soluzione contiene ioni
![]() , praticamente tutto lo ione
, praticamente tutto lo ione ![]() che si aggiunge
viene consumato e quindi la sua attivita' e' una funzione molto
``lenta'' del volume di soluzione titolante aggiunto. Quando viene
raggiunto il punto di equivalenza, l'attivita' degli ioni
che si aggiunge
viene consumato e quindi la sua attivita' e' una funzione molto
``lenta'' del volume di soluzione titolante aggiunto. Quando viene
raggiunto il punto di equivalenza, l'attivita' degli ioni ![]() in
soluzione si riduce praticamente a zero; di conseguenza, un'ulteriore
aggiunta di soluzione titolante provoca un incremento ``verticale''
dell'attivita' degli ioni
in
soluzione si riduce praticamente a zero; di conseguenza, un'ulteriore
aggiunta di soluzione titolante provoca un incremento ``verticale''
dell'attivita' degli ioni ![]() .
.
Queste variazioni dell'attivita' dello ione ![]() nel corso
della titolazione possono essere seguite convenientemente per via
potenziometrica impiegando un filo di
nel corso
della titolazione possono essere seguite convenientemente per via
potenziometrica impiegando un filo di ![]() come elettrodo indicatore.
come elettrodo indicatore.
Si e' visto infatti (p. ![]() ) che il potenziale
elettrodico del sistema
) che il potenziale
elettrodico del sistema ![]() e' dato da:
e' dato da:
In pratica, come gia' detto, il potenziale dell'elettrodo va misurato rispetto ad un riferimento, per cui cio' che si misura in realta' e' la differenza di potenziale tra l'elettrodo indicatore contenuto in una semicella in cui viene eseguita la titolazione e un elettrodo di riferimento contenuto in una seconda semicella accoppiata alla prima per formare una cella elettrochimica completa, del tipo discusso in precedenza (figura 1.8):
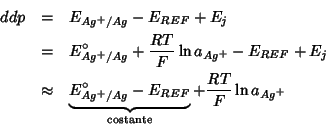
Questa relazione mostra come la differenze di potenziale misurabile e'
direttamente proporzionale al logaritmo naturale dell'attivita' degli
ioni ![]() in soluzione.
in soluzione.
La curva di titolazione viene costruita diagrammando i valori
di differenza di potenziale in funzione del volume di soluzione di
![]() aggiunto (figura 1.21).
aggiunto (figura 1.21).
Sono opportune alcune considerazioni:
e quindi:
Conoscendo
![]() ed
ed ![]() (e in condizioni tali
da poter trascurare eventuali potenziali di giunto), dalla misura
della differenza di potenziale al punto di equivalenza si puo'
determinare il prodotto di solubilita' di
(e in condizioni tali
da poter trascurare eventuali potenziali di giunto), dalla misura
della differenza di potenziale al punto di equivalenza si puo'
determinare il prodotto di solubilita' di ![]()
Grazie al valore molto diverso dei prodotti di solubilita'
(
![]() ),
e' anche possibile la titolazione di una miscela
),
e' anche possibile la titolazione di una miscela
![]() . In questo caso la curva di titolazione
presentera' due punti finali, il primo relativo agli ioni
. In questo caso la curva di titolazione
presentera' due punti finali, il primo relativo agli ioni ![]() ,
che danno l'alogenuro d'argento meno solubile.
,
che danno l'alogenuro d'argento meno solubile.
Dato il rapporto delle concentrazioni di ![]() e
e ![]() generalmente impiegate in questa esperienza, la curva di titolazione
relativa agli ioni
generalmente impiegate in questa esperienza, la curva di titolazione
relativa agli ioni ![]() viene ``troncata'' dalla precipitazione di
viene ``troncata'' dalla precipitazione di
![]() . In altre parole, l'attivita' degli ioni
. In altre parole, l'attivita' degli ioni ![]() in
soluzione supera il limite di precipitazione di
in
soluzione supera il limite di precipitazione di ![]() prima che il ``salto'' della curva di titolazione relativa
agli ioni
prima che il ``salto'' della curva di titolazione relativa
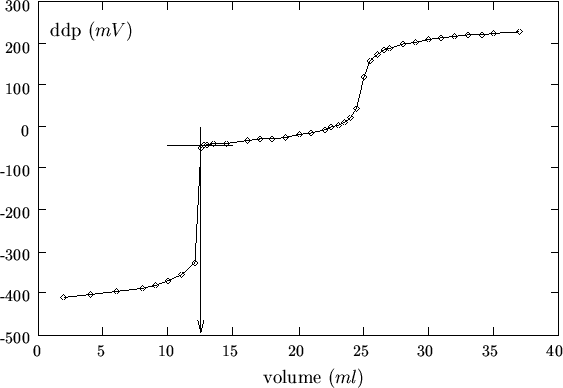
agli ioni ![]() sia completato1.1.effetto si rivela sotto forma di una cuspide che separa la curva di
titolazione per gli ioni
sia completato1.1.effetto si rivela sotto forma di una cuspide che separa la curva di
titolazione per gli ioni ![]() da quella per gli ioni
da quella per gli ioni ![]() (un
esempio concreto e' mostrato in figura 1.23). Siccome la
curva di titolazione per gli ioni
(un
esempio concreto e' mostrato in figura 1.23). Siccome la
curva di titolazione per gli ioni ![]() e' in realta' incompleta, il
punto finale relativo va preso in corrispondenza alla cuspide e non
all'apparente flesso (figura 1.23). Cio' naturalmente
comporta un errore (difficilmente prevedibile) sul dosaggio degli ioni
e' in realta' incompleta, il
punto finale relativo va preso in corrispondenza alla cuspide e non
all'apparente flesso (figura 1.23). Cio' naturalmente
comporta un errore (difficilmente prevedibile) sul dosaggio degli ioni
![]() ; tale errore, inoltre, si ripercuote inevitabilmente sulla
determinazione degli ioni
; tale errore, inoltre, si ripercuote inevitabilmente sulla
determinazione degli ioni ![]() (infatti, dal volume di
soluzione titolante corrispondente al flesso della curva relativa agli
ioni
(infatti, dal volume di
soluzione titolante corrispondente al flesso della curva relativa agli
ioni ![]() deve essere sottratto il volume di equivalenza
ottenuto per gli ioni
deve essere sottratto il volume di equivalenza
ottenuto per gli ioni ![]() ).
).
 |
Lo ione ![]() ossida quantitativamente il
ossida quantitativamente il ![]() a
a
![]() in ambiente acido, secondo:
in ambiente acido, secondo:
Questa reazione viene sfruttata per il dosaggio del ![]() con
soluzione standard di
con
soluzione standard di ![]() .
.
Man mano che la titolazione procede, il rapporto
![]() cresce a partire da un
valore iniziale molto piccolo e presenta un brusco salto in
corrispondenza al punto di equivalenza (il calcolo della curva di
titolazione e' illustrato nell'Appendice C).
cresce a partire da un
valore iniziale molto piccolo e presenta un brusco salto in
corrispondenza al punto di equivalenza (il calcolo della curva di
titolazione e' illustrato nell'Appendice C).
Se si immerge un filo di ![]() nella soluzione, il sistema elettrodico
cosi' ottenuto sara' caratterizzato da un potenziale legato, come
visto in precedenza (sezione 1.1.2) al rapporto suddetto dalla legge
di Nernst:
nella soluzione, il sistema elettrodico
cosi' ottenuto sara' caratterizzato da un potenziale legato, come
visto in precedenza (sezione 1.1.2) al rapporto suddetto dalla legge
di Nernst:
Appare dunque evidente che la titolazione puo' essere convenientemente seguita per via potenziometrica, utilizzando un elettrodo inerte come elettrodo indicatore.
Come al solito, si dovra' allestire una cella del tipo mostrato in figura 1.13.
L'elettrodo di riferimento puo' essere un elettrodo a calomelano
oppure ad ![]() . La curva di titolazione si costruisce riportando
i valori di differenza di potenziale misurati in funzione del volume
di soluzione di
. La curva di titolazione si costruisce riportando
i valori di differenza di potenziale misurati in funzione del volume
di soluzione di ![]() aggiunto
(figura 1.24). La tecnica di titolazione e' quella
discussa precedentemente in generale.
aggiunto
(figura 1.24). La tecnica di titolazione e' quella
discussa precedentemente in generale.
Va osservato che, per rendere la determinazione del punto finale piu'
agevole, si aggiunge alla soluzione da titolare un eccesso di
![]() . Infatti, il salto di differenza di potenziale che si
ha in corrispondenza al punto finale e' tanto maggiore quanto maggiore
e' la costante di equilibrio della reazione redox
(Appendice C). Lo ione
. Infatti, il salto di differenza di potenziale che si
ha in corrispondenza al punto finale e' tanto maggiore quanto maggiore
e' la costante di equilibrio della reazione redox
(Appendice C). Lo ione ![]() forma un
complesso molto stabile con lo ione
forma un
complesso molto stabile con lo ione ![]() , per cui, in
presenza di
, per cui, in
presenza di ![]() , si ha:
, si ha:
![\begin{eqnarray*}
6Fe^{2+}+Cr_2O_7^{2-}+14H^+&\stackrel{K_1}{\rightleftharpoons ...
...\rightleftharpoons }&6\left[Fe(HPO_4)\right]^++2Cr^{3+}+7H_2O\\
\end{eqnarray*}](img272.gif)
da cui si vede che la presenza di ![]() sposta l'equilibrio
redox verso destra.
sposta l'equilibrio
redox verso destra.