Si e' visto precedentemente in cosa consiste una titolazione
potenziometrica (p. ![]() ).
).
Dato che nel corso di Esercitazioni di Analisi Chimica Quantitativa vengono eseguite diverse esperienze di questo tipo, sembra opportuno a questo punto premettere alcune considerazioni generali al riguardo.
La soluzione da titolare viene posta in un recipiente opportuno: esso dovra' consentire la sistemazione degli elettrodi, di una barretta magnetica e della buretta contenete la soluzione titolante (figura 1.13).
Una volta scelti gli elettrodi appropriati, li si lava accuratamente con acqua distillata e li si immerge nella soluzione. A questo proposito va osservato che il contatto fra la soluzione test e la soluzione eventualmente contenuta negli elettrodi (e' questo il caso della maggior parte degli elettrodi di riferimento) e' generalmente realizzato tramite un setto poroso (della dimensione di una capocchia di spillo) incorporato nel tubo in vetro che contiene gli elettrodi stessi (figura 1.12): e' essenziale che tale setto poroso sia immerso nella soluzione test, altrimenti il contatto elettrico viene a mancare.
E' opportuno provvedere ad un'efficace agitazione magnetica.
La buretta contenente la soluzione titolante va sistemata in modo che il reagente fuoriesca senza spruzzi.
La titolazione viene eseguita annotando la differenza di potenziale
fra gli elettrodi dopo ogni aggiunta di titolante. Le aggiunte saranno
abbastanza grandi lontano dal punto finale (
![]() ) per ridursi a
) per ridursi a
![]() nelle sue
immediate vicinanze. Prima di ogni successiva aggiunta e' opportuno
attendere che la lettura rimanga stabile per circa
nelle sue
immediate vicinanze. Prima di ogni successiva aggiunta e' opportuno
attendere che la lettura rimanga stabile per circa ![]() (il
potenziale non deve variare piu' di
(il
potenziale non deve variare piu' di ![]() , il
, il ![]() di
di ![]() unita'). Una volta raggiunto il punto finale (la qual cosa
e' in genere indicata dalla brusca variazione della differenza di
potenziale misurata o del
unita'). Una volta raggiunto il punto finale (la qual cosa
e' in genere indicata dalla brusca variazione della differenza di
potenziale misurata o del ![]() , se si sta impiegando un elettrodo a
vetro con un pH-metro) si aggiunge ancora qualche millilitro di
soluzione titolante, aumentando il volume di ciascuna singola
aggiunta.
, se si sta impiegando un elettrodo a
vetro con un pH-metro) si aggiunge ancora qualche millilitro di
soluzione titolante, aumentando il volume di ciascuna singola
aggiunta.
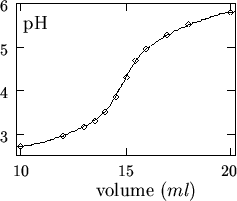
La curva di titolazione viene costruita riportando in grafico la
differenza di potenziale (o il ![]() ) in funzione del volume di
soluzione titolante aggiunto.
) in funzione del volume di
soluzione titolante aggiunto.
Una volta costruita la curva di titolazione, si pone il problema della determinazione del punto finale, corrispondente al flesso della curva.
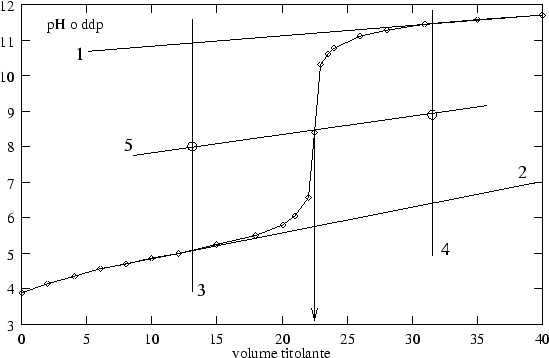
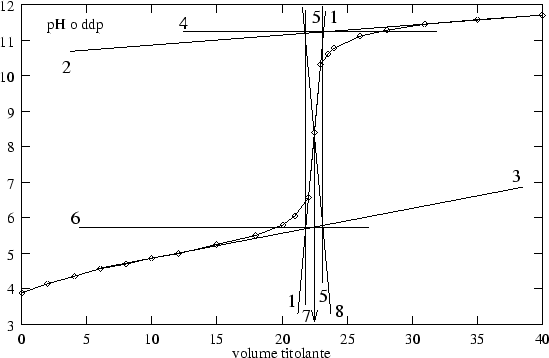
La cosa piu' semplice e' quella di stimare ad occhio la posizione del flesso. La precisione del risultato ottenibile con questo sistema e' tanto maggiore quanto piu' grande e' la variazione della curva in corrispondenza al punto finale.
Fra i molti metodi grafici per la determinazione del punto finale in una titolazione potenziometrica, si citano qui i seguenti due.
 |
 |
Allo scopo di aumentare la precisione (ad esempio quando il salto in
corrispondenza del punto finale non e' molto netto) si possono
elaborare i dati ottenuti ricavando la derivata prima e seconda della
curva di titolazione. Consideriamo come esempio una titolazione
acido-base. Al termine dell'esperienza si e' in possesso di una sequenza
di N coppie di valori ![]() . Allora e' possibile costruire una
sequenza di
. Allora e' possibile costruire una
sequenza di ![]() coppie di
valori
coppie di
valori
![]() , con:
, con:
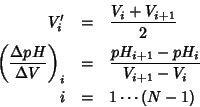
Il diagramma dei valori
![]() e'
quello corrispondente alla derivata prima della curva di titolazione e
percio' presentera' un picco acuto il cui massimo individua il punto
finale (figura 1.16).
e'
quello corrispondente alla derivata prima della curva di titolazione e
percio' presentera' un picco acuto il cui massimo individua il punto
finale (figura 1.16).
Il procedimento puo' essere ripetuto per ottenere la derivata
seconda. A partire dalle ![]() coppie di valori
coppie di valori
![]() e' possibile ricavare
e' possibile ricavare ![]() coppie di
dati
coppie di
dati
![]() , con:
, con:
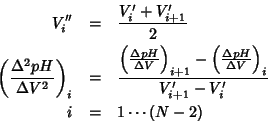
Il diagramma di tali valori e' quello corrispondente alla derivata seconda della curva di titolazione: presenta quindi una brusca oscillazione che taglia l'asse delle ascisse in corrispondenza al punto finale (figura 1.17).
Va osservato a questo punto che i metodi basati sulle derivate della curva di titolazione trovano impiego pratico solo se i dati sperimentali sono affetti da rumore molto limitato: l'operazione di derivazione comporta infatti un'inevitabile amplificazione dello scattering, portandolo in molti casi a livelli inaccettabili.
L'analisi della curva di titolazione puo' venir effettuata interamente per via numerica. Il metodo consiste nell'approssimazione dei dati sperimentali con un modello analitico. Uno fra i vari possibili e' il seguente:
Il primo termine rappresenta una curva sigmoide ed e' la parte piu'
significativa del modello. L'espressione cubica successiva e'
introdotta per permettere una migliore approssimazione dei dati
sperimentali in un intorno sufficientemente ampio del punto
finale. Vengono stimati dei valori di partenza per i parametri
![]() . Poi, con una procedura di ``best-fit'', tali valori
vengono affinati iterativamente fino ad ottenere la migliore
approssimazione possibile dei dati sperimentali. A questo punto, il
valore di
. Poi, con una procedura di ``best-fit'', tali valori
vengono affinati iterativamente fino ad ottenere la migliore
approssimazione possibile dei dati sperimentali. A questo punto, il
valore di ![]() corrispondente al flesso del modello fornisce il punto
finale cercato: tale valore e' ottenuto risolvendo l'equazione:
corrispondente al flesso del modello fornisce il punto
finale cercato: tale valore e' ottenuto risolvendo l'equazione:
Nella figura 1.18 e' mostrato un esempio concreto dell'applicazione di questa tecnica.
 |