Per gli scopi presenti, si puo' pensare ad un elettrodo come
ad un sistema caratterizzato da un'interfaccia che separa una fase
solida da una fase liquida. Un filo di ![]() immerso in una soluzione
di
immerso in una soluzione
di ![]() , un filo di
, un filo di ![]() immerso in una soluzione contenente
immerso in una soluzione contenente
![]() e
e ![]() o una pasta di
o una pasta di ![]() e
e ![]() in
contatto con una soluzione satura di
in
contatto con una soluzione satura di ![]() costituiscono tre esempi
di elettrodi.
costituiscono tre esempi
di elettrodi.
In un sistema elettrodico all'equilibrio esiste una differenza di
potenziale fra la fase solida e la soluzione con cui questa e' a
contatto. Tale differenza di potenziale si chiama potenziale
elettrodico e si indica generalmente con il simbolo
![]() . Per comprenderne qualitativamente
l'origine consideriamo due esempi concreti.
. Per comprenderne qualitativamente
l'origine consideriamo due esempi concreti.
Supponiamo di immergere un filo di ![]() in una soluzione di
in una soluzione di ![]() (figura 1.1).
(figura 1.1).
Subito dopo l'immersione del filo nella soluzione si instaurano due processi:
Il primo processo tende a caricare negativamente il metallo rispetto alla soluzione. Il secondo tende a produrre l'effetto contrario. Inizialmente le velocita' dei due processi sono (in generale) differenti. Tuttavia, dopo un tempo sufficiente, il processo inizialmente piu' veloce viene rallentato e quello inizialmente piu' lento viene accelerato finche' si raggiunge uno stato di equilibrio dinamico in cui fra il filo di Ag e la soluzione esiste una differenza di potenziale la cui entita' e' determinata dalla posizione raggiunta dall'equilibrio stesso.
Supponiamo, ad esempio, che al momento dell'immersione del filo di
argento nella soluzione (![]() ), la reazione di ossidazione sia piu'
veloce di quella di riduzione. Cio' significa che il metallo si
carichera' negativamente rispetto alla soluzione. Il campo elettrico
generato da tale separazione di carica, tuttavia, rallenta la reazione
di ossidazione (che consiste in un flusso di carica positiva con verso
opposto a quello del campo) e accelera quella di riduzione (in cui il
flusso di carica positiva e' nello stesso verso del campo). Col
trascorrere del tempo, il filo di argento continua a caricarsi
negativamente rispetto alla soluzione, ma contemporaneamente la
velocita' della reazione di ossidazione diminuisce mentre quella della
reazione di riduzione aumenta: il processo continua fino a che le
velocita' delle due reazioni si eguagliano. In tali
condizioni la differenza di potenziale fra metallo e soluzione (in
questo esempio negativa) non varia piu' nel tempo e rappresenta cio'
che si e' definito potenziale elettrodico.
), la reazione di ossidazione sia piu'
veloce di quella di riduzione. Cio' significa che il metallo si
carichera' negativamente rispetto alla soluzione. Il campo elettrico
generato da tale separazione di carica, tuttavia, rallenta la reazione
di ossidazione (che consiste in un flusso di carica positiva con verso
opposto a quello del campo) e accelera quella di riduzione (in cui il
flusso di carica positiva e' nello stesso verso del campo). Col
trascorrere del tempo, il filo di argento continua a caricarsi
negativamente rispetto alla soluzione, ma contemporaneamente la
velocita' della reazione di ossidazione diminuisce mentre quella della
reazione di riduzione aumenta: il processo continua fino a che le
velocita' delle due reazioni si eguagliano. In tali
condizioni la differenza di potenziale fra metallo e soluzione (in
questo esempio negativa) non varia piu' nel tempo e rappresenta cio'
che si e' definito potenziale elettrodico.
Vale la pena di osservare che i due processi all'origine della generazione del potenziale elettrodico sono uno l'inverso dell'altro e nel complesso costituiscono una semireazione redox.
Anche in questo caso, subito dopo l'immersione del filo, si instaurano due processi che tendono a caricare in modo opposto il metallo rispetto alla soluzione:
Analogamente al caso precedente, quando il sistema ha raggiunto
l'equilibrio, esiste una differenza di potenziale fra il filo di ![]() e la soluzione.
e la soluzione.
Come illustrato dai due esempi precedenti, un potenziale elettrodico e' dovuto all'equilibrio fra due reazioni opposte: un'ossidazione e una riduzione. Ci si aspetta quindi una relazione fra il potenziale elettrodico e le concentrazioni delle specie partecipanti alla semireazione elettrodica: tale relazione e' la legge di Nernst. Per una generica semireazione:
essa assume la forma:
![]() e' la costante universale dei gas,
e' la costante universale dei gas, ![]() e' la costante di
Faraday,
e' la costante di
Faraday, ![]() e' la temperatura assoluta e il termine logaritmico
contiene le attivita' delle specie partecipanti, ciascuna elevata al
proprio coefficiente stechiometrico: al numeratore compaiono le specie
che stanno dalla parte della forma ossidata, al denominatore quelle
che stanno dalla parte della forma ridotta nella semireazione.
e' la temperatura assoluta e il termine logaritmico
contiene le attivita' delle specie partecipanti, ciascuna elevata al
proprio coefficiente stechiometrico: al numeratore compaiono le specie
che stanno dalla parte della forma ossidata, al denominatore quelle
che stanno dalla parte della forma ridotta nella semireazione.
![]() si chiama potenziale standard e si vede che rappresenta la
differenza di potenziale fra metallo e soluzione quando l'attivita' di
tutte le specie che partecipano alla semireazione e'
unitaria.
si chiama potenziale standard e si vede che rappresenta la
differenza di potenziale fra metallo e soluzione quando l'attivita' di
tutte le specie che partecipano alla semireazione e'
unitaria. ![]() e' una caratteristica del sistema elettrodico.
e' una caratteristica del sistema elettrodico.
Vale la pena di sottolineare che la legge di Nernst e' una relazione termodinamica che vale esclusivamente in condizioni di equilibrio.
A titolo di esempio, scriviamo la legge di Nernst per i due casi particolari prima visti.
NOTA: l'attivita' dell'nel filo metallico e' costante e viene incorporata nel termine
:
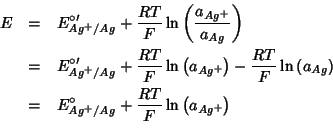
con: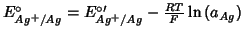
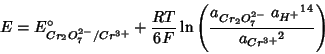
NOTA: l'attivita' dell'acqua e' assunta costante e viene incorporata nel termine, come visto nel caso precedente