Siamo ora nella posizione di poter discutere qualitativamente la dipendenza della corrente di elettrolisi dal tempo. A tale scopo facciamo cadere l'ipotesi di stazionarieta' stabilita all'inizio della sezione (2.2).
Consideriamo la cella di figura (2.1) e supponiamo di applicare una differenza di potenziale costante fra gli elettrodi: quale sara' l'andamento della corrente dopo la chiusura del circuito?
Col procedere dell'elettrolisi la composizione massiva dei due
comparti della cella cambia: in particolare, nel comparto catodico si
ha un aumento di ![]() e una diminuzione di
e una diminuzione di
![]() mentre in quello anodico si ha un aumento di
mentre in quello anodico si ha un aumento di
![]() e una diminuzione di
e una diminuzione di ![]() . Dalle
equazioni (2.3) e (2.4), si vede che cio' comporta una
diminuzione di
. Dalle
equazioni (2.3) e (2.4), si vede che cio' comporta una
diminuzione di ![]() e un aumento di
e un aumento di
![]() . Globalmente, quindi, la differenza
. Globalmente, quindi, la differenza
![]() aumenta nel tempo. Siccome la
differenza di potenziale applicata rimane costante,
dall'equazione (2.12) segue che i termini
aumenta nel tempo. Siccome la
differenza di potenziale applicata rimane costante,
dall'equazione (2.12) segue che i termini
![]() e
e
![]() devono
diminuire per compensazione.
devono
diminuire per compensazione.
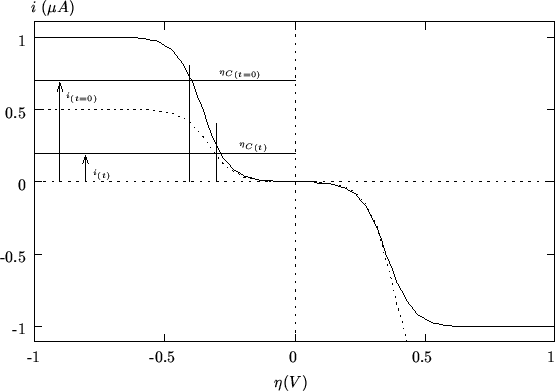
Nella figura 2.10 e' mostrata la caratteristica
![]() per la coppia redox che reagisce al catodo della cella da
elettrolisi: la porzione di interesse e' ovviamente il ramo catodico.
Siccome al catodo si ha consumo di specie
per la coppia redox che reagisce al catodo della cella da
elettrolisi: la porzione di interesse e' ovviamente il ramo catodico.
Siccome al catodo si ha consumo di specie ![]() , la corrente limite
catodica diminuisce nel tempo (equazione (2.21)) e la
caratteristica
, la corrente limite
catodica diminuisce nel tempo (equazione (2.21)) e la
caratteristica ![]() cambia come mostrato dalla curva
tratteggiata. Una diminuzione del termine
cambia come mostrato dalla curva
tratteggiata. Una diminuzione del termine
![]() richiede una diminuzione del modulo di
richiede una diminuzione del modulo di ![]() ed
ed ![]() (si
ricordi che e' sempre
(si
ricordi che e' sempre ![]() ): dalla figura
2.10 appare evidente che una diminuzione del modulo
di
): dalla figura
2.10 appare evidente che una diminuzione del modulo
di ![]() si puo' avere solo se la corrente
diminuisce. Considerando il ramo anodico della caratteristica
si puo' avere solo se la corrente
diminuisce. Considerando il ramo anodico della caratteristica
![]() della coppia redox che reagisce all'anodo, si puo'
verificare facilmente che anche una diminuzione del modulo di
della coppia redox che reagisce all'anodo, si puo'
verificare facilmente che anche una diminuzione del modulo di ![]() si
puo' produrre solo grazie ad una diminuzione della corrente. Si
conclude quindi che una diminuzione della sovratensione globale
si
puo' produrre solo grazie ad una diminuzione della corrente. Si
conclude quindi che una diminuzione della sovratensione globale
![]() si puo' realizzare solo grazie
ad una diminuzione della corrente nel tempo.
si puo' realizzare solo grazie
ad una diminuzione della corrente nel tempo.
 |
Dall'equazione (2.8) si vede immediatamente che un calo del termine di caduta ohmica richiede ancora una diminuzione della corrente di elettrolisi: possiamo quindi concludere che durante un'elettrolisi in cui la differenza di potenziale applicata viene mantenuta costante, la corrente, inizialmente elevata, decresce monotonicamente nel tempo.
Vale la pena di osservare che non si raggiungono mai delle condizioni
di corrente nulla. Infatti, anche quando le sostanze di interesse
presenti in soluzione sono state completamente ridotte od ossidate,
rimane pur sempre una corrente di fondo dovuta alla scarica del
solvente
![]() la cui
concentrazione massiva non viene in pratica alterata dal processo
elettrodico.
la cui
concentrazione massiva non viene in pratica alterata dal processo
elettrodico.