| (2.41) | |||
| (2.42) |
Nella sezione (2.2) e' stata analizzata in un certo dettaglio la dipendenza della corrente di elettrolisi dalla differenza di potenziale applicata fra gli elettrodi.
Prima di discutere la sua dipendenza dal tempo (si veda l'inizio della sezione (2.2), e' opportuno chiarire un altro aspetto, e precisamente il caso in cui nel comparto catodico e/o in quello anodico della cella di figura 2.1 sia presente piu' di una coppia redox capace di scambiare elettroni con l'elettrodo. A questo proposito, vale la pena di osservare che un caso simile rappresenta la norma piuttosto che un'eccezione, in quanto, oltre ad una particolare specie di interesse generalmente presente in soluzione, una specie elettroattiva ``ineliminabile'' e' il solvente. Ad esempio l'acqua puo' essere sia ridotta che ossidata secondo:
Ha dunque senso porsi la seguente domanda: se in prossimita' di un
elettrodo che si trovi inizialmente in condizioni di equilibrio si
trovano piu' specie capaci di ridursi (ossidarsi) e il potenziale
elettrodico viene diminuito (aumentato) rispetto al valore di
equilibrio in modo da causare il passaggio di una certa corrente di
riduzione (ossidazione) ![]() , quale sara' la frazione di tale corrente
dovuta alla riduzione (ossidazione) di ogni singola specie
elettroattiva?
, quale sara' la frazione di tale corrente
dovuta alla riduzione (ossidazione) di ogni singola specie
elettroattiva?
Tanto per fare un esempio concreto, supponiamo che nel comparto
catodico della cella di figura 2.1 si trovi una
soluzione acida di ioni ![]() .
.
In condizioni di equilibrio non si ha passaggio di
corrente. Applicando una sovratensione catodica (![]() ) si ha
passaggio di una corrente netta di riduzione
) si ha
passaggio di una corrente netta di riduzione ![]() . Tale corrente e'
dovuta a tutte le reazioni di riduzione che possono avvenire nella
soluzione:
. Tale corrente e'
dovuta a tutte le reazioni di riduzione che possono avvenire nella
soluzione:
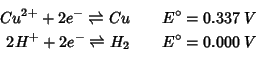
Detta ![]() la corrente dovuta alla riduzione degli ioni
la corrente dovuta alla riduzione degli ioni
![]() e
e ![]() quella dovuta alla riduzione degli ioni
quella dovuta alla riduzione degli ioni
![]() , dovra' essere:
, dovra' essere:
La domanda a cui vogliamo rispondere e': per ciascun valore del
potenziale catodico imposto, in che modo la corrente totale ![]() si
ripartisce fra i due contributi che compaiono
nell'equazione (2.43)?
si
ripartisce fra i due contributi che compaiono
nell'equazione (2.43)?
Evidentemente, la risposta a questa domanda e' contenuta nelle
caratteristiche ![]() delle coppie redox
delle coppie redox ![]() e
e
![]() : infatti, come si e' gia' visto, la caratteristica
: infatti, come si e' gia' visto, la caratteristica
![]() pertinente ad una certa coppia redox fornisce la
corrente dovuta a tale coppia per ogni valore di sovratensione.
pertinente ad una certa coppia redox fornisce la
corrente dovuta a tale coppia per ogni valore di sovratensione.
Consideriamo quindi una semicella nella quale siano presenti due
coppie redox ![]() e
e ![]() . Supponiamo che il
potenziale elettrodico imposto sia quello di equilibrio per la
semicella nelle condizioni date: cio' significa che la sovratensione
e' nulla (
. Supponiamo che il
potenziale elettrodico imposto sia quello di equilibrio per la
semicella nelle condizioni date: cio' significa che la sovratensione
e' nulla (![]() ). Immaginiamo a questo punto di diminuire il
potenziale elettrodico (il caso opposto e' perfettamente simmetrico):
si avra'
). Immaginiamo a questo punto di diminuire il
potenziale elettrodico (il caso opposto e' perfettamente simmetrico):
si avra' ![]() e si osservera' il passaggio di una corrente netta
di riduzione dovuta alle due reazioni:
e si osservera' il passaggio di una corrente netta
di riduzione dovuta alle due reazioni:
![]() e
e
![]() . Per ogni valore di sovratensione
(negativa), la corrente
. Per ogni valore di sovratensione
(negativa), la corrente ![]() dovuta alla riduzione:
dovuta alla riduzione:
![]() si ricava dal ramo catodico della
caratteristica
si ricava dal ramo catodico della
caratteristica ![]() relativa alla coppia
relativa alla coppia ![]() mentre la
corrente
mentre la
corrente ![]() dovuta alla riduzione:
dovuta alla riduzione:
![]() si ricava dal ramo catodico della caratteristica
si ricava dal ramo catodico della caratteristica ![]() relativa
alla coppia
relativa
alla coppia ![]() . La corrente catodica totale e' data dalla
somma delle correnti dovute alle due coppie redox presenti in
soluzione:
. La corrente catodica totale e' data dalla
somma delle correnti dovute alle due coppie redox presenti in
soluzione:
E' opportuno premettere alla discussione generale quella del caso
particolare in cui entrambe le coppie redox siano caratterizzate da
una corrente di scambio molto elevata (
![]() ): sotto questa
ipotesi restrittiva e' infatti possibile ricavare un'espressione
approssimata della caratteristica
): sotto questa
ipotesi restrittiva e' infatti possibile ricavare un'espressione
approssimata della caratteristica ![]() che evidenzia i principali
fattori da cui dipende la ripartizione della corrente totale nei due
contributi dovuti a ciascuna coppia redox.
che evidenzia i principali
fattori da cui dipende la ripartizione della corrente totale nei due
contributi dovuti a ciascuna coppia redox.
Per ricavare un'espressione approssimata della caratteristica
![]() nell'ipotesi
nell'ipotesi
![]() riprendiamo le relazioni
(2.23), (2.24) e (2.34):
riprendiamo le relazioni
(2.23), (2.24) e (2.34):
![% latex2html id marker 6898
$
\begin{array}{rclr}
\frac{C^\circ_{Ox}}{C^*_{Ox}}&...
...t(\left(1-\alpha\right) nf\eta\right)\right]&(\ref{electro:430})\\
\end{array}$](img478.gif)
Per l'ipotesi
![]() si ha:
si ha:
e quindi la relazione (2.34) si puo' scrivere come:
da cui si ricava facilmente:
Facendo il rapporto membro a membro delle equazioni (2.23) e (2.24) si ottiene:
Il rapporto
![]() puo' essere riscritto tenendo presente
la definizione di correnti limite (equazioni (2.21) e
(2.22)) e l'equazione di Nernst:
puo' essere riscritto tenendo presente
la definizione di correnti limite (equazioni (2.21) e
(2.22)) e l'equazione di Nernst:
Sostituendo la (2.46) nella (2.45) e riarrangiando si ottiene:
Infine, combinando la (2.47) con la (2.44) si ottiene, dopo opportuno riarrangiamento:
con:
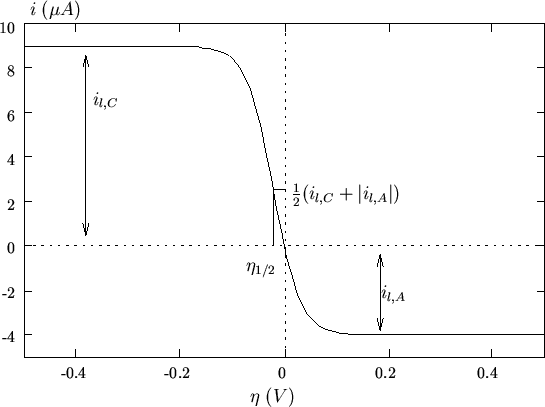
La relazione (2.48) rappresenta la caratteristica ![]() per
una coppia redox con corrente di scambio molto grande. Il suo
andamento e' mostrato nella figura 2.7: la funzione
per
una coppia redox con corrente di scambio molto grande. Il suo
andamento e' mostrato nella figura 2.7: la funzione
![]() presenta un flesso per
presenta un flesso per
![]() e il
valore della funzione al punto di flesso e'
e il
valore della funzione al punto di flesso e'
![]() .
.
 |
Torniamo ora alla semicella contenente le due coppie ![]() e
e
![]() . Per semplificare, supponiamo che il potenziale
elettrodico di equilibrio sia molto maggiore del massimo fra i due
potenziali standard
. Per semplificare, supponiamo che il potenziale
elettrodico di equilibrio sia molto maggiore del massimo fra i due
potenziali standard ![]() e
e ![]() delle coppie
redox. Dalla legge di Nernst:
delle coppie
redox. Dalla legge di Nernst:
si deduce che quanto sopra equivale ad avere, per una data
concentrazione totale
![]() ,
,
![]() e
e
![]() ; da cio' segue ancora che
; da cio' segue ancora che
![]() e
e
![]() . In queste condizioni si
ha dunque:
. In queste condizioni si
ha dunque:
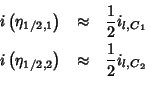
e quindi ![]() da' una misura della sovratensione necessaria
affinche' la corrente catodica associata a ciascuna coppia redox
assuma valori apprezzabili (figura 2.8).
da' una misura della sovratensione necessaria
affinche' la corrente catodica associata a ciascuna coppia redox
assuma valori apprezzabili (figura 2.8).
 |
Dalla relazione (2.49) (ricordando che abbiamo fatto l'ipotesi
![]() ) si conclude quindi che, a parita' di tutto il
resto, se la sovratensione viene diminuita a partire dal valore nullo,
comincera' a ridursi apprezzabilmente la coppia redox che ha
il potenziale standard maggiore (figura
2.8).
) si conclude quindi che, a parita' di tutto il
resto, se la sovratensione viene diminuita a partire dal valore nullo,
comincera' a ridursi apprezzabilmente la coppia redox che ha
il potenziale standard maggiore (figura
2.8).
Questo risultato e' stato ottenuto sotto l'ipotesi che entrambe le coppie redox presenti nella semicella catodica siano caratterizzate da una corrente di scambio molto elevata. Cio' equivale a dire che il processo di trasferimento elettronico superficiale e' caratterizzato da un'energia di attivazione molto bassa (cfr. sezione (2.2.2.2)). In tale situazione, e' ragionevole che il processo globale sia governato da criteri termodinamici, e il potenziale standard di una coppia redox rappresenta per l'appunto una misura della tendenza termodinamica della reazione di riduzione.
Naturalmente, e' stato considerato solo il caso di una semicella
catodica: il caso opposto, quello cioe' di una semicella anodica in
cui la sovratensione venga aumentata a partire dal valore nullo, e'
del tutto analogo; con i medesimi argomenti esposti per il caso di una
riduzione, si giunge facilmente alla conclusione che in una scansione
anodica (![]() ), comincera' ad ossidarsi apprezzabilmente
la coppia redox caratterizzata dal potenziale standard minore.
), comincera' ad ossidarsi apprezzabilmente
la coppia redox caratterizzata dal potenziale standard minore.
Resta infine da considerare il caso generale in cui le coppie redox
candidate alla riduzione o all'ossidazione presentino valori della
corrente di scambio non molto elevati. In tale circostanza non e'
possibile ottenere una versione semplificata della caratteristica
![]() , tuttavia l'effetto di una lentezza del trasferimento
elettronico (
, tuttavia l'effetto di una lentezza del trasferimento
elettronico (![]() ) e' facilmente razionalizzabile sulla base
di quanto detto in generale parlando dell'influenza del parametro
) e' facilmente razionalizzabile sulla base
di quanto detto in generale parlando dell'influenza del parametro
![]() (p.
(p.![]() ): come si e' visto, al diminuire di
): come si e' visto, al diminuire di
![]() il ramo catodico viene spostato a valori di
il ramo catodico viene spostato a valori di ![]() minori e
quello anodico a valori di
minori e
quello anodico a valori di ![]() maggiori (figura
2.4). Cio' fa si' che l'ordine di riduzione o di
ossidazione deducibile sulla base di sole considerazioni termodinamiche
(cioe' sulla base dei potenziali standard) possa essere alterato da
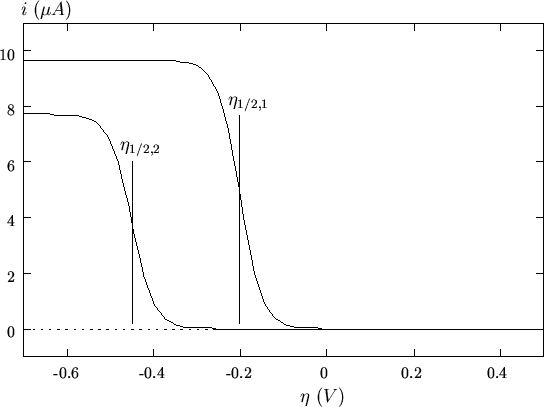
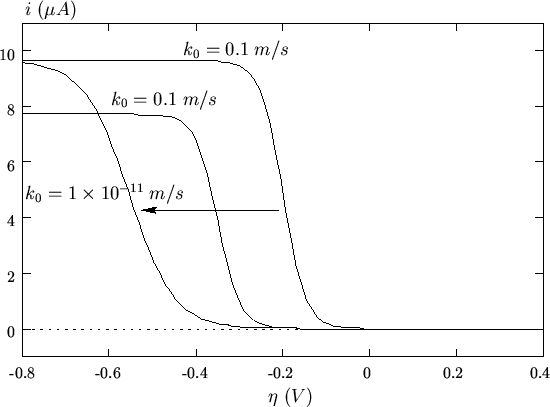
effetti cinetici rilevanti. Un'esemplificazione di quanto ora detto e'
illustrata nella figura 2.9: in una scansione catodica,
una coppia redox termodinamicamente favorita (cioe' caratterizzata da
un potenziale standard elevato) puo' iniziare a ridursi a
sovratensioni minori rispetto ad una coppia meno favorita, ma
dotata di una corrente di scambio piu' elevata.
maggiori (figura
2.4). Cio' fa si' che l'ordine di riduzione o di
ossidazione deducibile sulla base di sole considerazioni termodinamiche
(cioe' sulla base dei potenziali standard) possa essere alterato da
effetti cinetici rilevanti. Un'esemplificazione di quanto ora detto e'
illustrata nella figura 2.9: in una scansione catodica,
una coppia redox termodinamicamente favorita (cioe' caratterizzata da
un potenziale standard elevato) puo' iniziare a ridursi a
sovratensioni minori rispetto ad una coppia meno favorita, ma
dotata di una corrente di scambio piu' elevata.
 |
Vale ancora la pena di accennare alla possibilita' di
elettrodepositare selettivamente un solo ione metallico da una
soluzione contenente una miscela di diversi ioni sfruttando le diverse
caratteristiche ![]() dei componenti. Quando tali caratteristiche
siano sufficientemente distinte, e' possibile controllare la
sovratensione catodica in modo che la corrente sia dovuta
esclusivamente alla scarica del catione piu' facilmente riducibile,
che potra' cosi' essere determinato in presenza degli altri. Inoltre,
una volta terminata la deposizione del primo componente, la
sovratensione puo' essere aggiustata in modo da depositare quello
successivo e cosi' via.
dei componenti. Quando tali caratteristiche
siano sufficientemente distinte, e' possibile controllare la
sovratensione catodica in modo che la corrente sia dovuta
esclusivamente alla scarica del catione piu' facilmente riducibile,
che potra' cosi' essere determinato in presenza degli altri. Inoltre,
una volta terminata la deposizione del primo componente, la
sovratensione puo' essere aggiustata in modo da depositare quello
successivo e cosi' via.