Nella sezione precedente si e' visto come varia la corrente col tempo quando la differenza di potenziale viene mantenuta costante.
D'altro canto, esistono dispositivi che consentono di effettuare un'elettrolisi imponendo un valore costante alla corrente che circola nella cella. In questo caso sara' la differenza di potenziale fra gli elettrodi a variare nel corso dell'esperimento.
Tale variazione puo' essere discussa sempre sulle base
dell'equazione (2.12) e della caratteristica ![]() . Come si
e' gia' visto, il procedere dell'elettrolisi provoca un aumento di
. Come si
e' gia' visto, il procedere dell'elettrolisi provoca un aumento di
![]() e
e ![]() e una diminuzione di
e una diminuzione di
![]() e
e ![]() e quindi un aumento di
e quindi un aumento di
![]() e una diminuzione di
e una diminuzione di ![]() .
.
La variazione delle concentrazioni massive provoca altresi' delle
variazioni nelle caratteristiche ![]() delle coppie redox che
reagiscono nel comparto anodico e in quello catodico: dalle equazioni
(2.21) e (2.22) si deduce che si avra'
una diminuzione del modulo di
delle coppie redox che
reagiscono nel comparto anodico e in quello catodico: dalle equazioni
(2.21) e (2.22) si deduce che si avra'
una diminuzione del modulo di ![]() e
e ![]() . Il caso
della coppia redox che reagisce al catodo e' illustrato nella
figura 2.11 (quello della coppia redox che
reagisce all'anodo e' perfettamente analogo).
. Il caso
della coppia redox che reagisce al catodo e' illustrato nella
figura 2.11 (quello della coppia redox che
reagisce all'anodo e' perfettamente analogo).
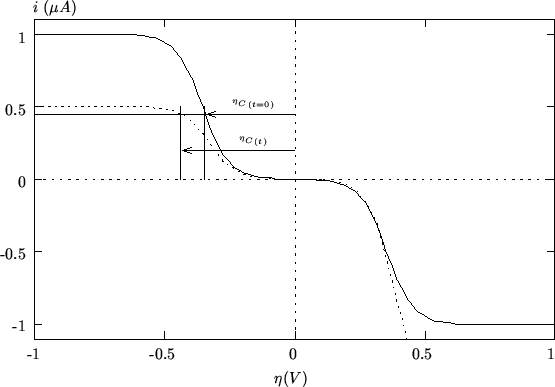 |
Siccome in questo caso la corrente ![]() viene mantenuta costante, un
esame della figura 2.11 consente di concludere
che si avra' un aumento del modulo di
viene mantenuta costante, un
esame della figura 2.11 consente di concludere
che si avra' un aumento del modulo di ![]() (in modo analogo si
puo' facilmente verificare che la diminuzione di
(in modo analogo si
puo' facilmente verificare che la diminuzione di ![]() combinata
con il fatto che la corrente rimane costante implica un aumento del
modulo di
combinata
con il fatto che la corrente rimane costante implica un aumento del
modulo di ![]() ). Ammettendo pure che i cambiamenti di composizione
non alterino la resistenza
). Ammettendo pure che i cambiamenti di composizione
non alterino la resistenza ![]() della soluzione (e quindi che il
termine di caduta ohmica
della soluzione (e quindi che il
termine di caduta ohmica
![]() resti costante), si vede
che, nel complesso, la differenza di potenziale fra gli elettrodi
aumenta. Cio' avviene finche' il potenziale catodico
resti costante), si vede
che, nel complesso, la differenza di potenziale fra gli elettrodi
aumenta. Cio' avviene finche' il potenziale catodico
![]() e quello anodico
e quello anodico
![]() si
attestano su valori tali che la corrente imposta esternamente viene
sostenuta dalla scarica catodica e anodica del solvente.
si
attestano su valori tali che la corrente imposta esternamente viene
sostenuta dalla scarica catodica e anodica del solvente.