La corrente che circola nella cella durante l'elettrolisi e' funzione della differenza di potenziale applicata agli elettrodi e del tempo. In questa sezione ci occuperemo di indagare in maggiore dettaglio la dipendenza dalla differenza di potenziale, mentre lo studio di quella temporale viene per il momento rinviato. A tale scopo supporremo che il flusso di corrente che circola nella cella sia stazionario.
La variazione della corrente di elettrolisi col tempo e' dovuta essenzialmente alle variazioni di composizione causate dall'elettrolisi stessa e cioe' alla formazione o scomparsa di specie chimiche in seguito alle reazioni elettrodiche.2.1 Nell'ipotesi di stazionarieta' possiamo immaginare che le specie prodotte per elettrolisi vengano continuamente rimosse dalla soluzione, mentre quelle consumate vengano continuamente rimpiazzate dall'esterno. In tali condizioni (realizzate ad esempio in una cella in flusso) la corrente dipende unicamente dalla differenza di potenziale applicata agli elettrodi ed e' appunto tale dipendenza che ci apprestiamo ora ad approfondire.
Si e' gia' visto che la differenza di potenziale da applicare deve
essere almeno pari alla differenza fra i potenziali elettrodici di
equilibrio:
![]() . Tale limite e' imposto dalla
termodinamica e rappresenta una differenza di potenziale appena
sufficiente a controbilanciare la tendenza spontanea della
reazione (2.5). Per poter osservare una corrente elettrica nel
verso voluto, dovra' essere:
. Tale limite e' imposto dalla
termodinamica e rappresenta una differenza di potenziale appena
sufficiente a controbilanciare la tendenza spontanea della
reazione (2.5). Per poter osservare una corrente elettrica nel
verso voluto, dovra' essere:
Il surplus di differenza di potenziale (rispetto al limite termodinamico su scritto) e' costituito da vari contributi che nel seguito cercheremo di evidenziare e spiegare.
Cominciamo con l'osservare che la soluzione compresa fra i due
elettrodi possiede una resistenza ![]() non trascurabile. Per forzare
attraverso il circuito una corrente
non trascurabile. Per forzare
attraverso il circuito una corrente ![]() bisogna che la differenza di
potenziale applicata contenga il termine necessario a vincere tale
resistenza. Questo termine e' dato dalla legge di Ohm ed e' percio'
detto caduta ohmica:
bisogna che la differenza di
potenziale applicata contenga il termine necessario a vincere tale
resistenza. Questo termine e' dato dalla legge di Ohm ed e' percio'
detto caduta ohmica:
Va notato che la resistenza della soluzione e' funzione di diversi
parametri, la composizione, la temperatura e la geometria della
cella. Osserviamo ancora che il termine di caduta ohmica e'
proporzionale alla corrente. Ad esempio, se durante l'elettrolisi si
desidera sostenere una corrente di ![]() e la resistenza della
soluzione (supposta costante) e' di
e la resistenza della
soluzione (supposta costante) e' di ![]() , la caduta ohmica
risulta pari a
, la caduta ohmica
risulta pari a ![]() .
.
Sulla base di quanto appena visto e di quanto detto nella
sezione (2.1), possiamo scrivere la differenza di
potenziale da applicare per ottenere il passaggio di una corrente ![]() nel modo seguente:
nel modo seguente:
L'indice ``i'' sta ad indicare che tutti i termini sono funzioni della corrente.
Il potenziale anodico e quello catodico possono essere espressi in termini dei
rispettivi valori di equilibrio e dello spostamento ![]() da tali valori:
da tali valori:
In tal modo:
La relazione (2.12) dice quale deve essere la differenza di
potenziale da applicare per ottenere una corrente di elettrolisi
![]() . Il termine
. Il termine
![]() non dipende da
non dipende da ![]() e rappresenta il valore che la differenza di potenziale deve avere per
mantenere il sistema all'equilibrio (
e rappresenta il valore che la differenza di potenziale deve avere per
mantenere il sistema all'equilibrio (![]() ). Vale tuttavia la pena di
osservare che tale termine varia nel corso dell'elettrolisi a causa
della variazione delle concentrazioni delle specie coinvolte nelle
reazioni elettrodiche (si vedano le
equazioni (2.3)-(2.4)).
). Vale tuttavia la pena di
osservare che tale termine varia nel corso dell'elettrolisi a causa
della variazione delle concentrazioni delle specie coinvolte nelle
reazioni elettrodiche (si vedano le
equazioni (2.3)-(2.4)).
I termini ![]() ed
ed ![]() piu' sopra introdotti vengono detti
rispettivamente sovratensione anodica e sovratensione catodica. Dalla
combinazione delle equazioni (2.10)-(2.11) con le
disuguaglianze (2.6)-(2.7) si deduce che quando il
circuito della cella e' attraversato da una corrente
piu' sopra introdotti vengono detti
rispettivamente sovratensione anodica e sovratensione catodica. Dalla
combinazione delle equazioni (2.10)-(2.11) con le
disuguaglianze (2.6)-(2.7) si deduce che quando il
circuito della cella e' attraversato da una corrente ![]() si ha
si ha
![]() ed
ed ![]() . Il termine
. Il termine
![]() e' dunque sempre positivo.
e' dunque sempre positivo.
Nel seguito verra' approfondita la relazione fra corrente e sovratensione.
In questa sezione ci occuperemo di indagare la dipendenza dalla
corrente dei termini ![]() ed
ed ![]() che compaiono
nell'equazione (2.12).
che compaiono
nell'equazione (2.12).
Come si vedra', l'origine della sovratensione ![]() e' completamente
indipendente dal fatto che un elettrodo funzioni da catodo o da
anodo. Quindi, per affrontare la discussione in termini piu' generali
possibile, concentriamo la nostra attenzione su una generica
interfaccia elettrodica caratterizzata da un potenziale elettrodico
e' completamente
indipendente dal fatto che un elettrodo funzioni da catodo o da
anodo. Quindi, per affrontare la discussione in termini piu' generali
possibile, concentriamo la nostra attenzione su una generica
interfaccia elettrodica caratterizzata da un potenziale elettrodico
![]() e in presenza della coppia redox:
e in presenza della coppia redox:
Se indichiamo con ![]() e
e ![]() le concentrazioni
massive2.2 delle specie
le concentrazioni
massive2.2 delle specie ![]() e
e ![]() , rispettivamente, allora
sappiamo che il potenziale di equilibrio
, rispettivamente, allora
sappiamo che il potenziale di equilibrio ![]() dell'interfaccia
e' dato dalla legge di Nernst:
dell'interfaccia
e' dato dalla legge di Nernst:
Quando
![]() , la velocita' della reazione di riduzione:
, la velocita' della reazione di riduzione:
e' uguale a quella della reazione di ossidazione (sezione (1.1.3)):
Il numero di elettroni (cariche) che attraversano l'interfaccia nell'unita' di tempo in un senso e in quello opposto e' lo stesso e la corrente netta risultante e' nulla.
Se
![]() , una delle due reazioni procede piu'
velocemente dell'altra e si ha una corrente netta risultante (catodica
o di riduzione se
, una delle due reazioni procede piu'
velocemente dell'altra e si ha una corrente netta risultante (catodica
o di riduzione se
![]() , anodica o di
ossidazione se
, anodica o di
ossidazione se
![]() )
)
La domanda a cui cercheremo di rispondere in questa sezione e' la
seguente: se il potenziale elettrodico differisce di ![]() dal
valore di equilibrio, quale sara' la corrispondente corrente netta
dal
valore di equilibrio, quale sara' la corrispondente corrente netta
![]() ?
?
Cominciamo con l'osservare che la corrente netta ![]() misura in
pratica la velocita' netta
misura in
pratica la velocita' netta ![]() del processo elettrodico
globale. Infatti, se indichiamo con
del processo elettrodico
globale. Infatti, se indichiamo con ![]() le moli di
le moli di ![]() ridotte
(corrente netta catodica) o quelle di
ridotte
(corrente netta catodica) o quelle di ![]() ossidate (corrente netta
anodica), allora (F e' la costante di Faraday):
ossidate (corrente netta
anodica), allora (F e' la costante di Faraday):
Siccome il processo elettrodico e' di tipo eterogeneo, cioe' e'
spazialmente localizzato all'interfaccia elettrodo/soluzione, la sua
velocita' globale e' direttamente proporzionale all'area ![]() di tale
interfaccia. Si puo' pertanto definire una velocita' per unita' di
area interfacciale (dimensioni
di tale
interfaccia. Si puo' pertanto definire una velocita' per unita' di
area interfacciale (dimensioni
![]() ):
):
per cui:
Il problema si sposta dunque alla determinazione della relazione fra
![]() ed
ed ![]() .
.
In generale, un processo elettrodico e' costituito da diversi stadi. Nel caso piu' semplice tali stadi sono tre (figura 2.2):
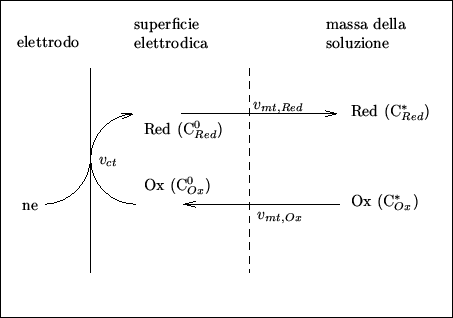 |
In generale, la velocita' globale con cui avviene il processo
elettrodico (cioe', per l'equazione (2.16), la corrente netta
![]() ) e' uguale alla piu' bassa delle velocita' individuali di questi
tre stadi.
) e' uguale alla piu' bassa delle velocita' individuali di questi
tre stadi.
In particolare, e' importante realizzare che, in condizioni
stazionarie, cioe' quelle che stiamo qui considerando,
cfr. sezione (2.2), detta ![]() la velocita' con cui
si muovono le specie ossidate,
la velocita' con cui
si muovono le specie ossidate, ![]() quella con cui si muovono
le specie ridotte e
quella con cui si muovono
le specie ridotte e ![]() la velocita' del trasferimento
elettronico, deve valere:
la velocita' del trasferimento
elettronico, deve valere:
Nel seguito ci occuperemo di mettere in relazione ![]() ,
,
![]() e
e ![]() (e quindi
(e quindi ![]() ) col potenziale elettrodico.
) col potenziale elettrodico.
La reazione elettrodica altera la composizione della soluzione alla superficie dell'elettrodo. Cio' comporta l'instaurarsi di gradienti di concentrazione che determinano il movimento di specie chimiche dalla superficie elettrodica alla soluzione e viceversa (cio' e' una conseguenza della legge generale per cui se la concentrazione di una specie chimica in una soluzione non e' spazialmente omogenea, essa tendera' a spostarsi dalle regioni piu' concentrate a quelle meno concentrate).
Consideriamo la nostra interfaccia elettrodica mentre e' attraversata
da una corrente stazionaria ![]() . In tali condizioni le concentrazioni
superficiali delle specie
. In tali condizioni le concentrazioni
superficiali delle specie ![]() e
e ![]() (
(![]() e
e
![]() , rispettivamente) saranno diverse da quelle massive
, rispettivamente) saranno diverse da quelle massive
![]() e
e ![]() , a causa della reazione elettrodica
(se la corrente netta e' di tipo catodico si avra':
, a causa della reazione elettrodica
(se la corrente netta e' di tipo catodico si avra':
![]() e
e
![]() ; se
invece la corrente netta e' di tipo anodico, si avra':
; se
invece la corrente netta e' di tipo anodico, si avra':
![]() e
e
![]() ). Come
detto sopra, questa disomogeneita' spaziale di concentrazione provoca
il movimento di molecole
). Come
detto sopra, questa disomogeneita' spaziale di concentrazione provoca
il movimento di molecole ![]() e
e ![]() dalla superficie elettrodica
alla soluzione e viceversa. La velocita'
dalla superficie elettrodica
alla soluzione e viceversa. La velocita' ![]() di tale movimento
e' approssimativamente proporzionale alla differenza fra la
concentrazione massiva e quella superficiale:
di tale movimento
e' approssimativamente proporzionale alla differenza fra la
concentrazione massiva e quella superficiale:
![]() ed
ed ![]() sono detti coefficienti di trasferimento di
massa e danno una misura di quanto rapidamente si spostano le molecole
di
sono detti coefficienti di trasferimento di
massa e danno una misura di quanto rapidamente si spostano le molecole
di ![]() e
e ![]() , rispettivamente.
, rispettivamente.
Tanto per fissare le idee consideriamo il caso di una corrente netta di riduzione (il caso opposto e' perfettamente analogo).
La situazione e' la seguente (figura 2.2):
In condizioni di stazionarieta', la velocita' di questi tre stadi deve essere la stessa. In particolare deve valere:
Osserviamo a questo punto che la definizione di ![]() e
e
![]() (equazioni (2.18) e (2.19)) implica la
convenzione elettrochimica secondo cui una corrente netta di riduzione
(
(equazioni (2.18) e (2.19)) implica la
convenzione elettrochimica secondo cui una corrente netta di riduzione
(
![]() e
e
![]() ) e'
positiva, mentre un corrente netta di ossidazione
(
) e'
positiva, mentre un corrente netta di ossidazione
(
![]() e
e
![]() ) e'
negativa.
) e'
negativa.
Osserviamo ancora che la velocita' con cui la specie ![]() puo'
raggiungere l'elettrodo non e' illimitata: essa raggiunge un valore
massimo quando
puo'
raggiungere l'elettrodo non e' illimitata: essa raggiunge un valore
massimo quando
![]() (equazione (2.18)). La corrente di
riduzione
(equazione (2.18)). La corrente di
riduzione ![]() che si ha in tali condizioni e' detta corrente
limite catodica ed e' data da:
che si ha in tali condizioni e' detta corrente
limite catodica ed e' data da:
Tale corrente rappresenta dunque la massima corrente catodica realizzabile nelle condizioni date.
In modo del tutto analogo si puo' vedere che, nel caso di una reazione netta di ossidazione, la massima corrente anodica raggiungibile e' data da:
(si ricordi che, per convenzione, le correnti anodiche sono negative).
Combinando le equazioni (2.18)-(2.22) si ottiene:
Le due relazioni su scritte rappresentano il risultato finale di questa sezione: esse esprimono la dipendenza della corrente (stazionaria) dal trasporto di massa in soluzione.
Osserviamo che lo scopo finale di questa trattazione e' quello di
ricavare una relazione fra ![]() ed
ed ![]() , mentre le equazioni
(2.23) e (2.24) contengono le concentrazioni
superficiali
, mentre le equazioni
(2.23) e (2.24) contengono le concentrazioni
superficiali ![]() e
e ![]() . In realta' abbiamo fin
qui considerato il solo processo di trasferimento di massa dei
reagenti e prodotti della reazione elettrodica dalla massa della
soluzione alla superficie elettrodica e viceversa; nel prossimo
paragrafo ricaveremo la dipendenza della velocita' del trasferimento
elettronico dal potenziale: come si vedra', anche in tale relazione
compaiono le concentrazioni superficiali delle specie partecipanti
alla reazione elettrodica e cio' dara' il modo di eliminarle dalla
relazione finale sfruttando i risultati qui ottenuti. Per il momento
resta da sottolineare che gli effetti del trasporto di massa sono
contenuti nei due parametri
. In realta' abbiamo fin
qui considerato il solo processo di trasferimento di massa dei
reagenti e prodotti della reazione elettrodica dalla massa della
soluzione alla superficie elettrodica e viceversa; nel prossimo
paragrafo ricaveremo la dipendenza della velocita' del trasferimento
elettronico dal potenziale: come si vedra', anche in tale relazione
compaiono le concentrazioni superficiali delle specie partecipanti
alla reazione elettrodica e cio' dara' il modo di eliminarle dalla
relazione finale sfruttando i risultati qui ottenuti. Per il momento
resta da sottolineare che gli effetti del trasporto di massa sono
contenuti nei due parametri ![]() ed
ed ![]() . Le correnti
limite dipendono a loro volta dalle concentrazioni massive e dai
coefficienti di trasferimento di massa
. Le correnti
limite dipendono a loro volta dalle concentrazioni massive e dai
coefficienti di trasferimento di massa ![]() ed
ed ![]() (equazioni (2.21)-(2.22)) . Questi ultimi, infine, sono
una misura della velocita' del trasferimento di massa (equazioni
(2.18)-(2.19)) e dipendono da una serie di variabili
sperimentali, quali l'agitazione della soluzione, la temperatura, il
peso molecolare e la carica ionica (ad esempio, in una soluzione
agitata e riscaldata il trasporto di massa e' molto piu' veloce).
(equazioni (2.21)-(2.22)) . Questi ultimi, infine, sono
una misura della velocita' del trasferimento di massa (equazioni
(2.18)-(2.19)) e dipendono da una serie di variabili
sperimentali, quali l'agitazione della soluzione, la temperatura, il
peso molecolare e la carica ionica (ad esempio, in una soluzione
agitata e riscaldata il trasporto di massa e' molto piu' veloce).
In questo paragrafo ci occuperemo dello stadio piu' propriamente ``chimico'' che costituisce il processo elettrodico globale e cioe' la reazione superficiale di trasferimento elettronico (figura 2.2).
La reazione di riduzione:
procede ad una velocita' ![]() proporzionale alla concentrazione
superficiale di specie
proporzionale alla concentrazione
superficiale di specie ![]() secondo:
secondo:
A tale reazione e' dunque associata una corrente catodica ![]() data da:
data da:
In modo analogo, per la reazione di ossidazione:
varra':
La velocita' netta della reazione di trasferimento elettronico e' data da:
In condizioni stazionarie si ha dunque (equazione (2.17)):
(si ricordi la convenzione per cui una corrente netta catodica e' positiva).
Siccome la reazione di riduzione e quella di ossidazione avvengono
all'interfaccia fra l'elettrodo e la soluzione, e' logico aspettarsi
che le loro costanti di velocita' dipendano pesantemente dalla
differenza di potenziale esistente attraverso tale interfaccia
(ricordiamo che la differenza di potenziale in questione non e' altro
che il potenziale elettrodico ![]() , p.
, p.![]() ). Si
trova in effetti che
). Si
trova in effetti che ![]() e
e ![]() dipendono esponenzialmente dal
potenziale elettrodico secondo:
dipendono esponenzialmente dal
potenziale elettrodico secondo:
dove ![]() e
e ![]() e
e ![]() sono parametri chiamati
rispettivamente costante di velocita' standard e coefficiente di
trasferimento.
sono parametri chiamati
rispettivamente costante di velocita' standard e coefficiente di
trasferimento. ![]() e' quasi sempre compreso fra 0 e 1.
e' quasi sempre compreso fra 0 e 1.
Quando
![]() , la reazione di riduzione e quella di
ossidazione hanno il medesimo valore della costante di velocita',
cioe'
, la reazione di riduzione e quella di
ossidazione hanno il medesimo valore della costante di velocita',
cioe' ![]() . La costante di velocita' standard da' quindi una misura
della mobilita' dell'equilibrio di scambio elettronico. Valori di
. La costante di velocita' standard da' quindi una misura
della mobilita' dell'equilibrio di scambio elettronico. Valori di
![]() diversi da
diversi da
![]() esaltano una delle due costanti e
deprimono l'altra. Com'e' logico aspettarsi, valori di
esaltano una delle due costanti e
deprimono l'altra. Com'e' logico aspettarsi, valori di ![]() maggiori
di
maggiori
di
![]() esaltano
esaltano ![]() e deprimono
e deprimono ![]() , cioe'
accelerano l'ossidazione e rallentano la riduzione. Il viceversa
avviene quando
, cioe'
accelerano l'ossidazione e rallentano la riduzione. Il viceversa
avviene quando
![]() .
.
Il coefficiente di trasferimento ![]() governa la simmetria della
dipendenza di
governa la simmetria della
dipendenza di ![]() e
e ![]() da
da ![]() (percio' viene anche detto
coefficiente di simmetria). Tanto per esemplificare, se
(percio' viene anche detto
coefficiente di simmetria). Tanto per esemplificare, se ![]() ,
allora il valore di
,
allora il valore di ![]() per
per
![]() e' uguale a quello di
e' uguale a quello di ![]() per
per
![]() . D'altro canto, se
. D'altro canto, se ![]() e'
molto diverso da
e'
molto diverso da ![]() (
(
![]() oppure
oppure
![]() ) l'effetto
su
) l'effetto
su ![]() dovuto ad un incremento di
dovuto ad un incremento di ![]() e' molto diverso da quello
su
e' molto diverso da quello
su ![]() causato da un decremento di
causato da un decremento di ![]() di pari entita'.
di pari entita'.
Sostituendo le equazioni (2.29) e (2.30) nell'equazione (2.28) si ottiene:
L'equazione (2.31) esprime la dipendenza della corrente dal potenziale elettrodico per effetto delle reazioni di trasferimento elettronico; il suo esame mostra che la corrente netta osservabile e' data dalla somma di due correnti ``parziali'' in direzioni opposte: una corrente catodica positiva e una corrente anodica negativa.
Come accennato nella sezione precedente, si vede che anche l'equazione (2.31) contiene le concentrazioni superficiali delle specie implicate nel processo elettrodico. Tali concentrazioni sono quanto meno difficili da misurare sperimentalmente. Per questo motivo vogliamo ora eliminarle dalla relazione finale. Cio' si realizza combinando l'equazione (2.31) con le equazioni (2.23) e (2.24) ricavate in precedenza. Tuttavia, prima di procedere, e' opportuno porre l'equazione (2.31) in una forma leggermente diversa.
Osserviamo innanzitutto che qualsiasi formulazione cinetica deve
ridursi ad un'espressione di tipo termodinamico nel limite di
condizioni di equilibrio. L'espressione (2.31) soddisfa tale
requisito. Infatti, se l'interfaccia elettrodica si trova in
condizioni di equilibrio, allora deve essere
![]() ed e' facile verificare che la (2.31) si riduce alla legge di
Nernst (2.3) o (2.4). In condizioni di equilibrio la
corrente catodica
ed e' facile verificare che la (2.31) si riduce alla legge di
Nernst (2.3) o (2.4). In condizioni di equilibrio la
corrente catodica ![]() e quella anodica
e quella anodica ![]() sono uguali. Si puo'
pertanto definire la cosiddetta corrente di scambio
sono uguali. Si puo'
pertanto definire la cosiddetta corrente di scambio ![]() come il
valore comune di
come il
valore comune di ![]() ed
ed ![]() in condizioni di equilibrio:
in condizioni di equilibrio:
Combinando le equazioni (2.32) e (2.33) con l'equazione
(2.31) e ricordando la definizione di sovratensione
(![]() ), si ottiene:
), si ottiene:
Prima di procedere e' ancora opportuna una considerazione sul significato della corrente di scambio.
Dalla relazione di Nernst si ricava:
Sostituendo l'equazione (2.35) nella (2.32) oppure l'equazione (2.36) nella (2.33) si ottiene il medesimo risultato, ovvero:
Si vede quindi che ![]() e' in relazione diretta con
e' in relazione diretta con ![]() . Il suo
significato e' perfettamente analogo: quando il sistema elettrodico si
trova all'equilibrio la corrente netta e' nulla, ma la reazione di
riduzione e quella di ossidazione procedono entrambe generando due
correnti ``parziali'' (
. Il suo
significato e' perfettamente analogo: quando il sistema elettrodico si
trova all'equilibrio la corrente netta e' nulla, ma la reazione di
riduzione e quella di ossidazione procedono entrambe generando due
correnti ``parziali'' (![]() e
e ![]() ) di uguale intensita', ma di
verso opposto.
) di uguale intensita', ma di
verso opposto. ![]() e' per l'appunto il valore comune
dell'intensita' di queste due correnti parziali e quindi misura la
mobilita' dell'equilibrio redox eterogeneo. Valori elevati di
e' per l'appunto il valore comune
dell'intensita' di queste due correnti parziali e quindi misura la
mobilita' dell'equilibrio redox eterogeneo. Valori elevati di ![]() indicano una reazione di trasferimento elettronico caratterizzata da
una bassa energia di attivazione; viceversa, valori di
indicano una reazione di trasferimento elettronico caratterizzata da
una bassa energia di attivazione; viceversa, valori di ![]() molto
bassi sono il risultato di una elevata energia di attivazione per il
trasferimento elettronico eterogeneo.
molto
bassi sono il risultato di una elevata energia di attivazione per il
trasferimento elettronico eterogeneo.
Come accennato nella sezione precedente, possiamo a questo punto combinare gli effetti del trasporto di massa e quelli della cinetica del trasferimento elettronico in un'unica relazione.
Grazie all'ipotesi di stazionarieta' della corrente (eq. (2.17)), le equazioni (2.23), (2.24) e (2.34) sono contemporaneamente valide. Possono quindi essere combinate eliminando le concentrazioni superficiali:
L'equazione (2.38) rappresenta la dipendenza della corrente
dalla sovratensione e fornisce la risposta alla domanda che ci
eravamo posti a p.![]() .
.
Data una coppia redox ![]() in soluzione, i valori di
in soluzione, i valori di
![]() ,
,![]() ,
,![]() ,
,
![]() ,
,![]() ,
,![]() ,
,![]() e
e ![]() rimangono
determinati. Da questi valori derivano quelli di
rimangono
determinati. Da questi valori derivano quelli di
![]() . A questo punto, per ogni valore di sovratensione
. A questo punto, per ogni valore di sovratensione
![]() , l'equazione (2.38) fornisce la corrente dovuta alla
riduzione netta
, l'equazione (2.38) fornisce la corrente dovuta alla
riduzione netta
![]() (
(![]() ) o all'ossidazione
netta
) o all'ossidazione
netta
![]() (
(![]() ).
).
L'andamento tipico della funzione ![]() (detta anche
caratteristica
(detta anche
caratteristica ![]() ) e' mostrato nella figura 2.3.
) e' mostrato nella figura 2.3.
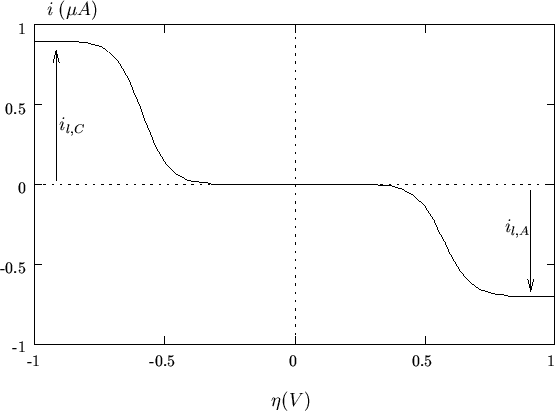 |
Come si puo' vedere, la funzione presenta un ramo catodico positivo
per valori di ![]() negativi e un ramo anodico negativo per valori
di
negativi e un ramo anodico negativo per valori
di ![]() positivi. Per
positivi. Per ![]() , cioe' all'equilibrio, si ha:
, cioe' all'equilibrio, si ha:
![]() , come deve essere.
, come deve essere.
Man mano che il potenziale elettrodico si discosta dal valore di
equilibrio (
![]() ) la corrente che
attraversa l'interfaccia cresce in modulo (il segno dipende da quello
di
) la corrente che
attraversa l'interfaccia cresce in modulo (il segno dipende da quello
di ![]() , come abbiamo gia' sottolineato piu' volte).
, come abbiamo gia' sottolineato piu' volte).
Date le condizioni di stazionarieta' che abbiamo assunto, il valore di
corrente corrispondente ad ogni valore di sovratensione e' una misura
della velocita' (comune) a cui avvengono il trasporto di massa e la
reazione elettrodica (eq. (2.17)). Tale velocita' sara' quella
dello stadio limitante il processo globale. Un'analisi
dell'eq. (2.34) mostra che la velocita' del trasferimento
elettronico eterogeneo cresce esponenzialmente (in modulo)
all'aumentare del modulo di ![]() ; d'altro canto, da quanto detto
nella sezione (2.2.2.1) si deduce che la velocita' del
trasporto di massa non puo' crescere indefinitamente, ma raggiunge un
plateau determinato dalle correnti limite (
; d'altro canto, da quanto detto
nella sezione (2.2.2.1) si deduce che la velocita' del
trasporto di massa non puo' crescere indefinitamente, ma raggiunge un
plateau determinato dalle correnti limite (![]() per un processo
netto di riduzione,
per un processo
netto di riduzione, ![]() per una ossidazione). Cio' ci consente
di discutere sommariamente l'andamento della caratteristica
per una ossidazione). Cio' ci consente
di discutere sommariamente l'andamento della caratteristica
![]() . Consideriamo per semplicita' il solo ramo catodico (la
discussione dell'andamento del ramo anodico e' ovviamente
speculare). Per piccoli valori di
. Consideriamo per semplicita' il solo ramo catodico (la
discussione dell'andamento del ramo anodico e' ovviamente
speculare). Per piccoli valori di ![]() la concentrazione
superficiale di
la concentrazione
superficiale di ![]() ,
, ![]() , e' solo di poco diversa da
quella massiva
, e' solo di poco diversa da
quella massiva ![]() : in tali condizioni la velocita' del
trasporto di massa non ha raggiunto ancora il suo valore massimo e il
processo limitante risulta essere quello del trasferimento
elettronico. Corrispondentemente, l'andamento della caratteristica
: in tali condizioni la velocita' del
trasporto di massa non ha raggiunto ancora il suo valore massimo e il
processo limitante risulta essere quello del trasferimento
elettronico. Corrispondentemente, l'andamento della caratteristica
![]() e' di tipo esponenziale, simile a quello
dell'eq. (2.34). Man mano che
e' di tipo esponenziale, simile a quello
dell'eq. (2.34). Man mano che ![]() cresce,
cresce, ![]() diminuisce finche' raggiunge un valore prossimo a
diminuisce finche' raggiunge un valore prossimo a ![]() : a questo punto
la velocita' del trasporto di massa ha raggiunto il suo massimo valore
possibile e un ulteriore diminuzione di
: a questo punto
la velocita' del trasporto di massa ha raggiunto il suo massimo valore
possibile e un ulteriore diminuzione di ![]() non puo' portare ad un
incremento della corrente di riduzione. La caratteristica
non puo' portare ad un
incremento della corrente di riduzione. La caratteristica ![]() si
appiattisce cosi' su un asintoto orizzontale e a questo punto l'intero
processo e' limitato dal trasporto di massa.
si
appiattisce cosi' su un asintoto orizzontale e a questo punto l'intero
processo e' limitato dal trasporto di massa.
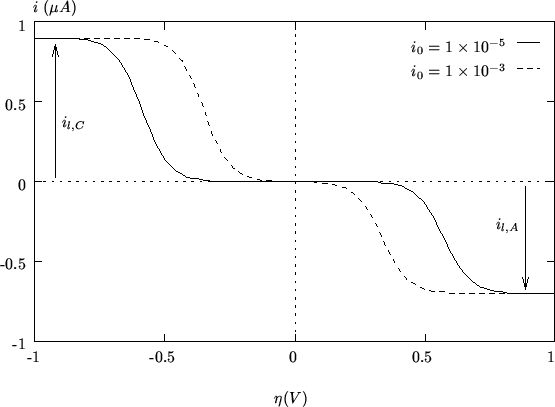
La velocita' dell' equilibrio di trasferimento elettronico,
rappresentata, come si e' detto, dal parametro ![]() , si riflette
sull'appiattimento della caratterisctica
, si riflette
sull'appiattimento della caratterisctica ![]() in un intorno
dell'origine (figura 2.4): in
pratica' piu' la reazione redox eterogenea e' lenta e maggiore deve
essere la sovratensione necessaria al passaggio di una determinata
corrente; in altre parole, un'elevata energia di attivazione per lo
stadio di trasferimento elettronico eterogeneo produce uno spostamento
del ramo catodico a sovratensioni minori e di quello anodico a
sovratensioni maggiori.
in un intorno
dell'origine (figura 2.4): in
pratica' piu' la reazione redox eterogenea e' lenta e maggiore deve
essere la sovratensione necessaria al passaggio di una determinata
corrente; in altre parole, un'elevata energia di attivazione per lo
stadio di trasferimento elettronico eterogeneo produce uno spostamento
del ramo catodico a sovratensioni minori e di quello anodico a
sovratensioni maggiori.
 |
La simmetria della curva e' governata dal fattore di simmetria
![]() : la sua influenza, a parita' del resto, e' illustrata nella
figura 2.5.
: la sua influenza, a parita' del resto, e' illustrata nella
figura 2.5.
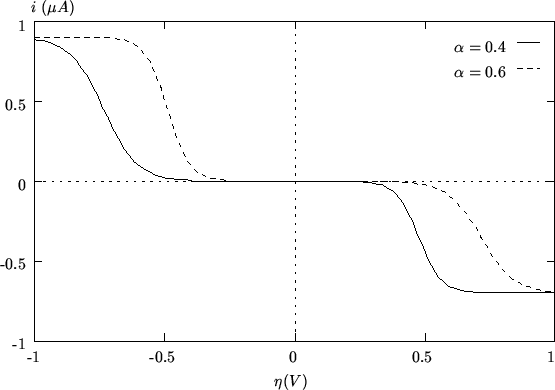 |
La relazione (2.38) puo' essere scritta in una forma
semplificata che evidenzia in modo piu' diretto il contributo dovuto
al trasporto di massa (contenuto nei parametri ![]() e
e ![]() )
e quello dovuto alla cinetica del trasferimento elettronico (contenuto
essenzialmente nel parametro
)
e quello dovuto alla cinetica del trasferimento elettronico (contenuto
essenzialmente nel parametro ![]() ).
).
Per valori di ![]() sufficientemente piccoli, gli esponenziali al
numeratore nell'equazione (2.38) possono essere approssimati
con le rispettive serie di Taylor troncate al termine lineare:
sufficientemente piccoli, gli esponenziali al
numeratore nell'equazione (2.38) possono essere approssimati
con le rispettive serie di Taylor troncate al termine lineare:
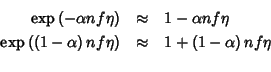
Sostituendo nell'equazione (2.38), restringendosi a valori di
![]() tali che
tali che
![]() e riarrangiando si ottiene:
e riarrangiando si ottiene:
L'equazione (2.39) e' formalmente identica alla legge di Ohm in cui i termini in parentesi giocano il ruolo di resistenze. Definendo:
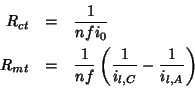
si ha:
Per ottenere passaggio di una determinata corrente attraverso
un'interfaccia elettrodica, il potenziale di quest'ultima deve essere
aumentato (per una corrente netta anodica) o diminuito (per una
corrente netta catodica) rispetto al valore di equilibrio di una
quantita' ![]() . In generale, per un valore fissato di corrente,
. In generale, per un valore fissato di corrente,
![]() e' tanto maggiore quanto minori sono i parametri caratteristici
e' tanto maggiore quanto minori sono i parametri caratteristici
![]() ,
, ![]() ed
ed ![]() . Dalla relazione (2.40) si vede
che
. Dalla relazione (2.40) si vede
che ![]() e' esprimibile come somma di due contributi: il termine
e' esprimibile come somma di due contributi: il termine
![]() , detto sovratensione di attivazione, e' necessario a
vincere la barriera di attivazione che si oppone al trasferimento
elettronico eterogeneo; il termine
, detto sovratensione di attivazione, e' necessario a
vincere la barriera di attivazione che si oppone al trasferimento
elettronico eterogeneo; il termine ![]() , detto sovratensione di
concentrazione, e' necessario a vincere la lentezza del movimento
delle specie attive dalla soluzione alla superficie elettrodica e
viceversa.
, detto sovratensione di
concentrazione, e' necessario a vincere la lentezza del movimento
delle specie attive dalla soluzione alla superficie elettrodica e
viceversa.
I due contributi alla sovratensione ![]() possono avere peso simile
oppure uno puo' essere nettamente prevalente sull'altro. Cosi', ad
esempio, se una coppia redox e' caratterizzata da una corrente di
scambio
possono avere peso simile
oppure uno puo' essere nettamente prevalente sull'altro. Cosi', ad
esempio, se una coppia redox e' caratterizzata da una corrente di
scambio ![]() molto piu' grande delle correnti limite
molto piu' grande delle correnti limite ![]() ed
ed
![]() , si avra':
, si avra':
![]() e quindi:
e quindi:
![]() : cioe' la quasi totalita' della sovratensione
da fornire per ottenere una certa corrente viene impiegata per forzare
il movimento delle specie attive nella soluzione, mentre una volta che
queste giungono alla superficie elettrodica scambiano gli elettroni
molto rapidamente.
: cioe' la quasi totalita' della sovratensione
da fornire per ottenere una certa corrente viene impiegata per forzare
il movimento delle specie attive nella soluzione, mentre una volta che
queste giungono alla superficie elettrodica scambiano gli elettroni
molto rapidamente.
Le considerazioni svolte nella sezione (2.2.2) sono
del tutto generali e si applicano sia al catodo che all'anodo della
cella di elettrolisi. La coppia ![]() che reagisce al catodo
sara' caratterizzata da una certa caratteristica
che reagisce al catodo
sara' caratterizzata da una certa caratteristica ![]() : il termine
: il termine
![]() che compare nell'equazione (2.12) e'
ricavabile dal ramo catodico di tale curva (si noti che cio' richiede
la conoscenza dei parametri
che compare nell'equazione (2.12) e'
ricavabile dal ramo catodico di tale curva (si noti che cio' richiede
la conoscenza dei parametri ![]() ,
, ![]() ,
, ![]() ed
ed ![]() per la coppia
per la coppia ![]() ). Analogamente, la coppia
). Analogamente, la coppia ![]() che
reagisce all'anodo avra' una caratteristica
che
reagisce all'anodo avra' una caratteristica ![]() dal ramo anodico
della quale e' possibile (conoscendo i parametri necessari) ricavare
il termine
dal ramo anodico
della quale e' possibile (conoscendo i parametri necessari) ricavare
il termine
![]() che compare
nell'equazione (2.12). Un'esemplificazione di quanto detto e'
mostrata nella figura 2.6
che compare
nell'equazione (2.12). Un'esemplificazione di quanto detto e'
mostrata nella figura 2.6
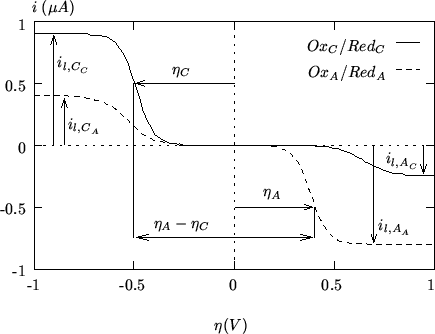 |
Possiamo a questo punto riassumere quanto detto sulla relazione fra corrente di elettrolisi e differenza di potenziale applicata.
La differenza di potenziale che bisogna applicare per ottenere una
corrente ![]() e' esprimibile come somma di vari contributi
(equazione (2.12)):
e' esprimibile come somma di vari contributi
(equazione (2.12)):
La sovratensione e la caduta ohmica dipendono dalla corrente crescendo al crescere di essa. Questo comporta che, com'e' ovvio aspettarsi, per ottenere correnti maggiori bisogna aumentare la differenza di potenziale applicata agli elettrodi.