 |
Si puo' definire elettrolisi l'insieme dei processi chimici che accompagnano il passaggio di corrente elettrica attraverso un'interfaccia elettrodica.
In questa sezione si cerchera' di spiegare in modo semplice:
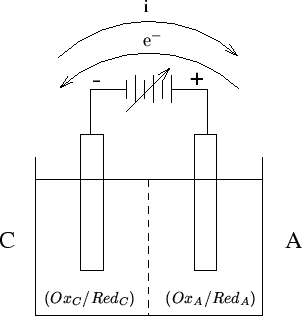
Una tipica cella da elettrolisi e' schematizzata nella figura 2.1.
Nei due comparti della cella sono immersi due elettrodi inerti (ad esempio due retine di platino).
La soluzione del comparto di sinistra (che contraddistingueremo con la lettera C) contiene i membri della coppia redox:
in concentrazione pari a ![]() e
e ![]() ,
rispettivamente. La soluzione nel comparto di destra (che
contraddistingueremo con la lettera A) contiene i membri della coppia
redox:
,
rispettivamente. La soluzione nel comparto di destra (che
contraddistingueremo con la lettera A) contiene i membri della coppia
redox:
in concentrazione pari a ![]() e
e ![]() ,
rispettivamente. I due comparti sono separati da un setto poroso, una
membrana iono-permeabile o un qualsiasi altro sistema che, pur
consentendo il passsaggio di corrente, impedisca il diretto
mescolamento delle due soluzioni.
,
rispettivamente. I due comparti sono separati da un setto poroso, una
membrana iono-permeabile o un qualsiasi altro sistema che, pur
consentendo il passsaggio di corrente, impedisca il diretto
mescolamento delle due soluzioni.
Supponiamo dapprima che il circuito esterno che connette i due elettrodi sia aperto e che le soluzioni contenute nei due comparti siano in condizioni di equilibrio. Come abbiamo gia' visto parlando della potenziometria (sezione (1.1.2)), cio' significa che in ciascuna semicella la reazione di ossidazione e quella di riduzione procedono alla stessa velocita' in versi opposti e ciascun sistema elettrodico sara' caratterizzato da un potenziale dato dalla legge di Nernst.
Supponiamo ora che sia:
![]() (il caso opposto
e'perfettamente simmetrico) e ci poniamo la seguente domanda: che cosa
avviene se si connettono i due elettrodi con un semplice conduttore
metallico?
(il caso opposto
e'perfettamente simmetrico) e ci poniamo la seguente domanda: che cosa
avviene se si connettono i due elettrodi con un semplice conduttore
metallico?
Osserviamo in primo luogo che, dalla definizione di potenziale
elettrodico (p.![]() ), si ha:
), si ha:
(assumiamo che il potenziale di giunto sia trascurabile dimodoche' il potenziale elettrostatico della soluzione nelle due semicelle e' lo stesso)
Da quanto sopra, si deduce che, all'atto della connessione dei due elettrodi, gli elettroni presenti sull'elettrodo a potenziale minore (C) tenderanno a fluire verso l'elettrodo a potenziale maggiore (A) (gli elettroni sono carichi negativamente). Questo flusso di elettroni, a sua volta, squilibra le reazioni elettrodiche nelle due semicelle: nella semicella C la reazione (2.1) viene spostata nel verso della ossidazione (infatti, la connessione esterna dei due elettrodi ha come effetto la sottrazione di elettroni dal metallo C e cio' fa si' che il sistema tenda a riprodurli, per il principio di LeChatelier); nella semicella A la reazione (2.2) viene spostata nel verso della riduzione (infatti, la connessione esterna dei due elettrodi ha come effetto l'accumulo di elettroni sul metallo A e cio' fa si' che il sistema tenda a consumarli, per il principio di LeChatelier).
Quindi, possiamo rispondere alla domanda che ci eravamo posti piu'
sopra: se si connettono i due elettrodi con un semplice conduttore
metallico si avra' un flusso spontaneo di elettroni dall'elettrodo a
potenziale minore (C) a quello a potenziale maggiore (A); nel
contempo, nella semicella C si osservera' una reazione netta di
ossidazione mentre nella semicella A avra' luogo una reazione netta di
riduzione: il risultato globale delle reazioni che avvengono in
ciascuna delle due semicelle e' la riduzione di ![]() a spese di
a spese di
![]() :
:
Da quanto sopra si deduce che tanto maggiore e' il potenziale elettrodico di equilibrio, tanto minore e' la variazione di energia libera per la reazione elettrodica scritta nel verso della riduzione.
Siccome siamo nell'ipotesi
![]() , cio' significa
che, nelle condizioni date,
, cio' significa
che, nelle condizioni date,
![]() , cioe'
, cioe' ![]() tende a ridursi a
tende a ridursi a ![]() piu' di quanto
piu' di quanto ![]() tenda a
ridursi a
tenda a
ridursi a ![]() .
.
Combinando le due reazioni su scritte si ottiene:
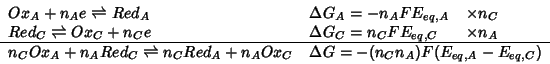
da cui si vede che, essendo
![]() , la variazione di
energia libera per la reazione costituita dalla somma delle due
reazioni elettrodiche e' negativa e quindi tale reazione tende ad
avvenire spontaneamente nel verso su scritto.
, la variazione di
energia libera per la reazione costituita dalla somma delle due
reazioni elettrodiche e' negativa e quindi tale reazione tende ad
avvenire spontaneamente nel verso su scritto.
Allora, se
i due elettrodi vengono connessi con un semplice filo metallico,
all'elettrodo C si avra' ossidazione di ![]() ad
ad ![]() e
all'elettrodo A si avra' riduzione di
e
all'elettrodo A si avra' riduzione di ![]() a
a ![]() : la cella
funzionera' come una pila e nel circuito esterno si avra' un
flusso di elettroni diretto dall'elettrodo C all'elettrodo A.
: la cella
funzionera' come una pila e nel circuito esterno si avra' un
flusso di elettroni diretto dall'elettrodo C all'elettrodo A.
Si e' dunque visto come la connessione esterna dei due elettrodi tramite un semplice conduttore (in generale un carico passivo) fa procedere la reazione globale costituita dalla somma delle due reazioni nette che avvengono nelle due semicelle nel verso spontaneo (termodinamicamente favorito).
In genere, tuttavia, un esperimento di elettrolisi viene effettuato
per far avvenire una reazione nella direzione opposta a quella in cui
procederebbe spontaneamente (se si volesse effettivamente ridurre
![]() e ossidare
e ossidare ![]() , basterebbe mescolarli assieme in un
bicchiere!). Ci poniamo allora la seguente domanda: come possiamo far
procedere la reazione (2.5) in verso opposto?
, basterebbe mescolarli assieme in un
bicchiere!). Ci poniamo allora la seguente domanda: come possiamo far
procedere la reazione (2.5) in verso opposto?
Si e' visto che, in pratica, la reazione globale (2.5) avviene a causa di un flusso di elettroni che, spostandosi da un elettrodo all'altro, squilibrano le reazioni elettrodiche in ciascuna delle due semicelle. Appare dunque evidente che la reazione (2.5) procedera' nel verso opposto a quello scritto se si invertira' il flusso degli elettroni. Infatti, se si connettono i due elettrodi in modo tale che gli elettroni fluiscano dall'elettrodo A all'elettrodo C, sulla base delle considerazioni gia' svolte, si arriva facilmente alla conclusione che nella semicella C si osservera' una reazione netta di riduzione e nella semicella A una reazione netta di ossidazione. La reazione globale sara' dunque:
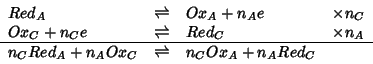
cioe' l'inversa della reazione (2.5).
Per far fluire gli elettroni dall'elettrodo A all'elettrodo C, e'
sufficiente connettere i due elettrodi tramite una sorgente di
differenza di potenziale opposta a quella gia' esistente e maggiore di
essa in modulo. Nel caso che stiamo considerando
(
![]() ), il polo positivo della sorgente di differenza
di potenziale dovra' essere collegato con l'elettrodo A
(figura 2.1). Se la differenza di potenziale applicata
e' esattamente uguale a
), il polo positivo della sorgente di differenza
di potenziale dovra' essere collegato con l'elettrodo A
(figura 2.1). Se la differenza di potenziale applicata
e' esattamente uguale a
![]() ,
allora il sistema si trova all'equilibrio (non si avra' flusso di
elettroni). Se la differenza di potenziale applicata e'
maggiore di tale limite, si avra' un flusso di elettroni
dall'elettrodo A all'elettrodo C e la reazione (2.5) procedera'
nel verso non spontaneo, come gia' detto.
,
allora il sistema si trova all'equilibrio (non si avra' flusso di
elettroni). Se la differenza di potenziale applicata e'
maggiore di tale limite, si avra' un flusso di elettroni
dall'elettrodo A all'elettrodo C e la reazione (2.5) procedera'
nel verso non spontaneo, come gia' detto.
Alle stesse conclusioni si giunge dall'analisi dei potenziali
elettrodici di equilibrio espressi tramite la legge di Nernst. Se la
differenza di potenziale applicata e' maggiore di
![]() , allora il potenziale
, allora il potenziale ![]() dell'elettrodo A (che
chiameremo anodo) viene forzato ad un valore maggiore di
quello richiesto dalla legge di Nernst. Analogamente il potenziale
dell'elettrodo A (che
chiameremo anodo) viene forzato ad un valore maggiore di
quello richiesto dalla legge di Nernst. Analogamente il potenziale
![]() dell'elettrodo C ( che chiameremo
catodo) viene forzato ad un valore minore di quello di equilibrio:
dell'elettrodo C ( che chiameremo
catodo) viene forzato ad un valore minore di quello di equilibrio:
Siccome al
potenziale catodico e' stato imposto un valore minore di quello di
equilibrio, la composizione della soluzione nelle sue immediate
vicinanze tende a cambiare per cercare di adeguarsi alle nuove
condizioni (per il principio di LeChatelier). Dalla relazione di
Nernst (eq. (2.3)) si vede che tale cambiamento deve consistere
in una diminuzione del rapporto
![]() . Quindi, una diminuzione del
potenziale elettrodico rispetto al valore di equilibrio, fa si che la
reazione che caratterizza la coppia redox
. Quindi, una diminuzione del
potenziale elettrodico rispetto al valore di equilibrio, fa si che la
reazione che caratterizza la coppia redox ![]() proceda nel
verso della riduzione:
proceda nel
verso della riduzione:
In modo del tutto analogo si giunge alla conclusione che all'interfaccia anodica, il cui potenziale e' forzato ad un valore maggiore di quello di equilibrio, si instaura un processo netto di ossidazione:
Il risultato globale e' quindi, di nuovo:
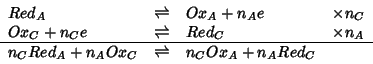
I nomi ``catodo'' e ``anodo'' precedentemente introdotti sono in relazione con il tipo di processo che avviene all'interfaccia elettrodica: si definisce anodo l'elettrodo a cui avviene un processo netto di ossidazione; si definisce catodo l'elettrodo a cui avviene un processo netto di riduzione.
La legge di Kirchoff sulla conservazione della carica, richiede che il flusso di cariche nel circuito esterno della cella sia accompagnato da un flusso equivalente nella parte ``liquida'' del circuito. Cio' e' assicurato dal movimento degli ioni in soluzione, che si spostano sotto l'influsso del campo elettrico dovuto alla differenza di potenziale esistente fra i due elettrodi.
Possiamo a questo punto riassumere brevemente quanto detto:
Vale la pena di sottolineare la differenza fondamentale tra quanto trattato nel capitolo riguardante la potenziometria e quanto verra' esposto nella presente sezione. In potenziometria si misurano differenze di potenziale in condizioni di equilibrio. In tali condizioni vale la legge di Nernst, che lega le attivita' delle specie presenti in soluzione alle differenze di potenziale misurate. Cio' costituisce, in ultima analisi, il fondamento per le applicazioni analitiche delle tecniche potenziometriche. Nel caso dell'elettrogravimetria, invece, il sistema costituito dalla cella di elettrolisi si trova in condizioni di non equilibrio: ma, per quanto si e' appena visto, e' proprio questa la condizione necessaria affinche' si abbia un passaggio di corrente. E' tale passaggio di corrente che determina la deposizione della specie da determinare su uno dei due elettrodi che costituiscono la cella da elettrolisi. Quindi, mentre le tecniche potenziometriche sono applicabili grazie alla realizzazione di celle in condizioni di equilibrio, quelle elettrogravimetriche richiedono la realizzazione di celle in condizioni di non equilibrio.