4.
Quando un sistema elettrodico
raggiunge l'equilibrio, si crea una separazione di carica elettrica
fra metallo e soluzione: sul metallo si accumula un eccesso di carica
(positiva o negativa), controbilanciato da una quantita' di carica
uguale ma di segno opposto nella soluzione; si puo' dire
equivalentemente che in tali condizioni esiste una differenza di
potenziale elettrostatico fra metallo e soluzione. Questa differenza
di potenziale, che per convenzione e' sempre misurata come differenza
fra il potenziale del metallo e quello della soluzione
(e non viceversa), si chiama potenziale elettrodico e si indica
generalmente con il simbolo ![]() .
.
Lo scopo della discussione che segue e' quello di giustificare in modo semplice cio' che abbiamo appena enunciato.
5.
Tanto per fissare le idee, consideriamo un sistema
elettrodico particolarmente semplice: un filo di ![]() immerso in una
soluzione di
immerso in una
soluzione di ![]() .
.
Prima di venire immerso nella soluzione, il filo di argento e'
elettricamente neutro, cioe' la sua carica elettrica risultante e'
nulla. A questo proposito, conviene pensare il filo di ![]() come
costituito da un reticolo fisso di ioni
come
costituito da un reticolo fisso di ioni ![]() permeato dal ``gas''
degli elettroni di valenza (ogni atomo di argento contribuisce un
elettrone di valenza): il fatto che inizialmente il filo sia
elettricamente neutro significa semplicemente che ogni ione
permeato dal ``gas''
degli elettroni di valenza (ogni atomo di argento contribuisce un
elettrone di valenza): il fatto che inizialmente il filo sia
elettricamente neutro significa semplicemente che ogni ione ![]() del reticolo e' neutralizzato dal suo elettrone di valenza.
del reticolo e' neutralizzato dal suo elettrone di valenza.
Inizialmente, la neutralita' elettrica vale anche per la soluzione,
dove ogni ione ![]() e' neutralizzato da un corrispondente
controione
e' neutralizzato da un corrispondente
controione ![]() .
.
Appena si immerge il filo di argento nella soluzione, la semireazione
elettrodica relativa alla coppia redox ![]() comincia ad
avvenire. Tale reazione consiste di due processi che sono uno
l'inverso dell'altro:
comincia ad
avvenire. Tale reazione consiste di due processi che sono uno
l'inverso dell'altro:
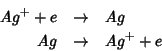
6. Ciascuno di questi due processi provoca dei cambiamenti nella concentrazione e nella distribuzione della carica elettrica fra metallo e soluzione.
La riduzione tende a produrre un eccesso di carica positiva nel
filo metallico e un corrispondente eccesso di carica negativa nella
soluzione: infatti, man mano che ioni argento (cioe' particelle con
carica elettrica positiva) abbandonano la soluzione per depositarsi
sul metallo, questo si carica positivamente (ogni ione ![]() ``nuovo arrivato'' non ha un elettrone di valenza che lo neutralizzi);
d'altro canto, nella soluzione rimangono ioni
``nuovo arrivato'' non ha un elettrone di valenza che lo neutralizzi);
d'altro canto, nella soluzione rimangono ioni ![]() (cioe'
particelle con carica elettrica negativa) in eccesso.
(cioe'
particelle con carica elettrica negativa) in eccesso.
E' chiaro, inoltre, che la riduzione provoca altresi' una diminuzione
della concentrazione di ioni ![]() nella soluzione.
nella soluzione.
La ossidazione tende a produrre effetti contrari a quelli della
riduzione. Ogni atomo di argento che abbandona il metallo passando in
soluzione come ione monopositivo, lascia sul filo di argento il suo
elettrone di valenza, cioe' una carica negativa; inoltre, gli ioni
![]() che passano in soluzione non sono neutralizzati da alcun
controione e quindi determinano un accumulo di carica positiva nella
soluzione.
che passano in soluzione non sono neutralizzati da alcun
controione e quindi determinano un accumulo di carica positiva nella
soluzione.
Per quanto riguarda i cambiamenti di concentrazione, e' ovvio che
l'ossidazione tende a produrre un aumento della concentrazione di ioni
![]() nella soluzione.
nella soluzione.
7. La cosa importante e' che la riduzione e l'ossidazione avvengono contemporaneamente e quindi i cambiamenti netti nella distribuzione della carica elettrica e nella concentrazione dipenderanno dalla velocita' relativa dei due processi.
Se inizialmente la riduzione e' piu' veloce dell'ossidazione, cio'
significa che, nell'unita' di tempo, sono piu' gli ioni ![]() che
dalla soluzione si depositano sul metallo che non quelli che dal
metallo passano in soluzione ; conseguentemente, il metallo assumera'
una carica netta positiva (e la soluzione una corrispondente carica
netta negativa) e la concentrazione di ioni
che
dalla soluzione si depositano sul metallo che non quelli che dal
metallo passano in soluzione ; conseguentemente, il metallo assumera'
una carica netta positiva (e la soluzione una corrispondente carica
netta negativa) e la concentrazione di ioni ![]() in soluzione
diminuira'. Ad esempio, se in
in soluzione
diminuira'. Ad esempio, se in ![]()
![]() ioni
ioni
![]() si depositano sul metallo e solo
si depositano sul metallo e solo ![]() atomi di
atomi di ![]() lo
abbandonano per andare in soluzione, si e' avuto un passaggio netto di
lo
abbandonano per andare in soluzione, si e' avuto un passaggio netto di
![]() ioni
ioni ![]() dalla soluzione al metallo; conseguentemente, sul
metallo si e' accumulata una carica positiva netta pari a
dalla soluzione al metallo; conseguentemente, sul
metallo si e' accumulata una carica positiva netta pari a
![]() e nella soluzione si e' accumulata una carica netta
negativa pari a
e nella soluzione si e' accumulata una carica netta
negativa pari a ![]() (cioe' ci sono
(cioe' ci sono ![]() ioni
ioni ![]() non
neutralizzati da corrispondenti ioni
non
neutralizzati da corrispondenti ioni ![]() ); inoltre, la
concentrazione di ioni
); inoltre, la
concentrazione di ioni ![]() in soluzione ha avuto un calo
netto corrispondente alla scomparsa di
in soluzione ha avuto un calo
netto corrispondente alla scomparsa di ![]() ioni
ioni ![]() .
.
Se l'ossidazione e' inizialmente piu' veloce della riduzione,
cio' vuol dire che, nell'unita' di tempo, sono piu' gli ioni ![]() che dal metallo vanno in soluzione che non quelli che dalla soluzione
si depositano sul metallo; la conseguenza e' che, in questo caso, il
metallo assumera' una carica netta negativa (e la soluzione una
corrispondente carica netta positiva) e la concentrazione di ioni
che dal metallo vanno in soluzione che non quelli che dalla soluzione
si depositano sul metallo; la conseguenza e' che, in questo caso, il
metallo assumera' una carica netta negativa (e la soluzione una
corrispondente carica netta positiva) e la concentrazione di ioni
![]() in soluzione aumentera'.
in soluzione aumentera'.
8. I cambiamenti dovuti al fatto che le velocita' iniziali della riduzione e dell'ossidazione sono (in generale) diverse non continuano pero' all'infinito. Infatti vedremo fra un momento che, proprio a causa di questi cambiamenti, il processo inizialmente piu' veloce viene progressivamente rallentato e quello inizialmente piu' lento viene progressivamente accelerato finche', inevitabilmente, si raggiunge la situazione in cui le due velocita' diventano uguali.
E' questa la condizione di equilibrio dinamico, che caratterizza tutte le reazioni chimiche: da questo momento in poi la separazione di carica e la concentrazione in soluzione rimangono costanti nel tempo.
9.
Per comprendere bene come mai le velocita'
della riduzione e della ossidazione, inizialmente diverse,
inevitabilmente finiscano per uguagliarsi, facciamo riferimento alla
figura 1.2 dove e' schematizzato un elettrodo ad
![]() a diversi istanti di tempo: la freccia diretta verso
destra rappresenta la velocita' di ossidazione mentre quella diretta
verso sinistra rappresenta la velocita' di riduzione (il verso delle
frecce e' stato fatto arbitrariamente coincidere con la direzione di
movimento degli ioni
a diversi istanti di tempo: la freccia diretta verso
destra rappresenta la velocita' di ossidazione mentre quella diretta
verso sinistra rappresenta la velocita' di riduzione (il verso delle
frecce e' stato fatto arbitrariamente coincidere con la direzione di
movimento degli ioni ![]() : cioe', l'ossidazione produce un flusso
di ioni
: cioe', l'ossidazione produce un flusso
di ioni ![]() dalla sbarretta metallica alla soluzione, mentre la
riduzione causa il movimento degli ioni
dalla sbarretta metallica alla soluzione, mentre la
riduzione causa il movimento degli ioni ![]() dalla soluzione al
metallo).
dalla soluzione al
metallo).
![\begin{psfrags}
\psfrag{p}{{$\oplus$}}
\psfrag{m}{{$\ominus$}}
\psfrag{ag}{{$Ag$...
...E}[c][c]{{$t\rightarrow\infty$}}
\includegraphics {equilibrium.eps}\end{psfrags}](img57.gif)
|
Come si vede, abbiamo assunto che a ![]() l'ossidazione sia piu'
veloce della riduzione (cioe' la freccia verso destra e' piu' lunga
della freccia verso sinistra). In base a quanto gia' detto al
punto 7, cio' implica che il metallo iniziera' a
caricarsi negativamente e la concentrazione di ioni
l'ossidazione sia piu'
veloce della riduzione (cioe' la freccia verso destra e' piu' lunga
della freccia verso sinistra). In base a quanto gia' detto al
punto 7, cio' implica che il metallo iniziera' a
caricarsi negativamente e la concentrazione di ioni ![]() in
soluzione aumentera'. Vediamo pero' cosa succede dopo che e' trascorso
un piccolo intervallo di tempo (figura 1.2,
in
soluzione aumentera'. Vediamo pero' cosa succede dopo che e' trascorso
un piccolo intervallo di tempo (figura 1.2,
![]() ).
).
Sul metallo si e' accumulato un eccesso di carica negativa e nella
soluzione si trova un corrispondente eccesso di carica positiva. Tutti
sappiamo che cariche elettriche dello stesso segno si respingono e
cariche di segno opposto si attraggono. Sulla base di questa semplice
considerazione, giungiamo alla conclusione che la separazione di
carica venutasi a creare ostacolera' la reazione di ossidazione
e facilitera' quella di riduzione. Infatti per uno ione
![]() sara' ora piu' difficile lasciare un elettrone (negativo) sul
metallo che contiene un eccesso di carica negativa e andare in
soluzione dove si trova un eccesso di carica positiva (che lo
``respinge''). Viceversa, sara' piu' facile per uno ione
sara' ora piu' difficile lasciare un elettrone (negativo) sul
metallo che contiene un eccesso di carica negativa e andare in
soluzione dove si trova un eccesso di carica positiva (che lo
``respinge''). Viceversa, sara' piu' facile per uno ione
![]() abbandonare la soluzione (esso sara' ``spinto'' dall'eccesso
di carica positiva) e depositarsi sul metallo (che lo ``attirera' ''
grazie all'eccesso di carica negativa). Vediamo quindi che la
separazione di carica prodotta inizialmente provoca proprio un
rallentamento del processo piu' veloce (l'ossidazione) e
un'accelerazione del processo piu' lento (la riduzione), come avevamo
preannunciato.
abbandonare la soluzione (esso sara' ``spinto'' dall'eccesso
di carica positiva) e depositarsi sul metallo (che lo ``attirera' ''
grazie all'eccesso di carica negativa). Vediamo quindi che la
separazione di carica prodotta inizialmente provoca proprio un
rallentamento del processo piu' veloce (l'ossidazione) e
un'accelerazione del processo piu' lento (la riduzione), come avevamo
preannunciato.
Oltre all'effetto della separazione di carica, c'e' da considerare
anche quello dell' aumento di concentrazione di ioni ![]() in
soluzione (l'effetto della concentrazione non e' rappresentato nella
figura per non appesantirla troppo). In generale, la velocita' di un
processo chimico cresce al crescere della concentrazione dei
reagenti. Nel caso dell'ossidazione, il reagente e' l'argento
metallico, la cui concentrazione rimane costante (sapreste
dimostrarlo?). Nel caso della riduzione, invece, il reagente e' lo
ione
in
soluzione (l'effetto della concentrazione non e' rappresentato nella
figura per non appesantirla troppo). In generale, la velocita' di un
processo chimico cresce al crescere della concentrazione dei
reagenti. Nel caso dell'ossidazione, il reagente e' l'argento
metallico, la cui concentrazione rimane costante (sapreste
dimostrarlo?). Nel caso della riduzione, invece, il reagente e' lo
ione ![]() , la cui concentrazione in soluzione e' aumentata
(nell'ipotesi che stiamo considerando): cio' provochera', per quanto
appena detto, un corrispondente aumento della velocita' della
riduzione (il processo inizialmente piu' lento). La velocita'
dell'ossidazione non risente invece di effetti di concentrazione
(perche' la concentrazione dell'argento metallico non varia): anche i
cambiamenti di concentrazione tendono quindi a ``livellare'' le
velocita' della riduzione e dell'ossidazione.
, la cui concentrazione in soluzione e' aumentata
(nell'ipotesi che stiamo considerando): cio' provochera', per quanto
appena detto, un corrispondente aumento della velocita' della
riduzione (il processo inizialmente piu' lento). La velocita'
dell'ossidazione non risente invece di effetti di concentrazione
(perche' la concentrazione dell'argento metallico non varia): anche i
cambiamenti di concentrazione tendono quindi a ``livellare'' le
velocita' della riduzione e dell'ossidazione.
Col trascorrere del tempo, la sbarretta di argento continua a
caricarsi negativamente rispetto alla soluzione e la concentrazione di
ioni ![]() continua a crescere, ma proprio percio' la velocita'
dell'ossidazione continua a diminuire mentre quella della riduzione
continua ad aumentare (figura 1.2,
continua a crescere, ma proprio percio' la velocita'
dell'ossidazione continua a diminuire mentre quella della riduzione
continua ad aumentare (figura 1.2, ![]() ,
,
![]() ): e' inevitabile che queste due velocita' finiscano per
diventare uguali (figura 1.2,
): e' inevitabile che queste due velocita' finiscano per
diventare uguali (figura 1.2,
![]() ). In tali condizioni il numero di ioni
). In tali condizioni il numero di ioni ![]() che abbandonano il metallo nell'unita' di tempo a causa
dell'ossidazione e' uguale a quello degli ioni
che abbandonano il metallo nell'unita' di tempo a causa
dell'ossidazione e' uguale a quello degli ioni ![]() che dalla
soluzione si depositano sul metallo a causa della riduzione: ne segue
che l'eccesso di carica negativa sul filo di argento e la
concentrazione di ioni
che dalla
soluzione si depositano sul metallo a causa della riduzione: ne segue
che l'eccesso di carica negativa sul filo di argento e la
concentrazione di ioni ![]() in soluzione smettono di aumentare e
la differenza di potenziale fra metallo e soluzione (in questo esempio
negativa) non varia piu' nel tempo. Il sistema elettrodico ha
raggiunto l'equilibrio e la differenza di potenziale che si e' cosi'
stabilita fra il filo di argento e la soluzione e' cio' che si
definisce potenziale elettrodico.
in soluzione smettono di aumentare e
la differenza di potenziale fra metallo e soluzione (in questo esempio
negativa) non varia piu' nel tempo. Il sistema elettrodico ha
raggiunto l'equilibrio e la differenza di potenziale che si e' cosi'
stabilita fra il filo di argento e la soluzione e' cio' che si
definisce potenziale elettrodico.
E' importante osservare che, in condizioni di equilibrio, l'ossidazione e la riduzione non si sono fermate, ma continuano ad avvenire entrambe alla stessa velocita' (con riferimento alla figura, le frecce non sono scomparse, ma sono diventate della stessa lunghezza).
10. Nell'esempio considerato, abbiamo fatto l'ipotesi che, inizialmente, l'ossidazione fosse piu' veloce della riduzione: provate a ripetere il ragionamento nel caso opposto in cui la riduzione sia inizialmente piu' veloce dell'ossidazione.
Per inciso: e se le due velocita' iniziali sono identiche? Nulla di
nuovo: significa semplicemente che il sistema si trova gia'
all'equilibrio; non si avra' alcun accumulo di carica ne' variazioni
di concentrazione: il potenziale elettrodico in questo caso sara' pari
a ![]() .
.
Abbiamo discusso il caso di un elettrodo ad ![]() , ma gli stessi
argomenti si applicano in modo identico a qualsiasi altro sistema
elettrodico. Provate a descrivere da soli cio' che accade quando si
immerge un filo di
, ma gli stessi
argomenti si applicano in modo identico a qualsiasi altro sistema
elettrodico. Provate a descrivere da soli cio' che accade quando si
immerge un filo di ![]() in una soluzione contenente concentrazioni
date di ioni
in una soluzione contenente concentrazioni
date di ioni ![]() e
e ![]() . L'unica variante, in questo
caso, e' che nessuno dei due membri della coppia redox si deposita
sull'elettrodo, il cui unico scopo e' quello di fornire elettroni alla
forma ossidata o accettarne dalla forma ridotta:
. L'unica variante, in questo
caso, e' che nessuno dei due membri della coppia redox si deposita
sull'elettrodo, il cui unico scopo e' quello di fornire elettroni alla
forma ossidata o accettarne dalla forma ridotta:
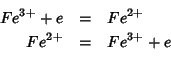
Analogamente all'esempio precedente, la riduzione tende ad accumulare
carica positiva sul metallo (carica negativa in soluzione), a
diminuire la concentrazione di ioni ![]() e ad aumentare quella
degli ioni
e ad aumentare quella
degli ioni ![]() ; l'ossidazione tende invece a fare esattamente
il contrario. Inizialmente la velocita' dei due processi sara' diversa e
quindi...
; l'ossidazione tende invece a fare esattamente
il contrario. Inizialmente la velocita' dei due processi sara' diversa e
quindi...
A beneficio di coloro che si trovano a proprio agio piu' con i numeri che con le parole, nell'appendice A e' sviluppato un semplicissimo modello che descrive matematicamente il raggiungimento dell'equilibrio di una semireazione e il concomitante instaurarsi del potenziale elettrodico.