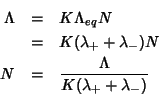
54. Siamo ora equipaggiati del bagaglio necessario a discutere le applicazioni analitiche della conduttimetria. In analogia a quanto visto per le analisi potenziometriche, si distingue fra conduttimetria diretta e indiretta.
55. Nelle misure conduttimetriche dirette si effettua una singola misura di conducibilita' e si ricava la concentrazione incognita dell'analita di interesse dall'applicazione diretta della relazione:
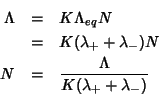
Come si vede, le misure dirette richiedono, oltre alla misura di
![]() con un conduttimetro, la conoscenza piu' accurata
possibile di
con un conduttimetro, la conoscenza piu' accurata
possibile di ![]() (punto 43) e delle
conducibilita' equivalenti individuali degli ioni da cui e' costituito
l'elettrolita da dosare. Ricordate che, mentre i valori delle
conducibilita' ioniche individuali a diluizione infinita non
dipendono dalla concentrazione, quelle a diluizione finita
dipendono (anche se poco) dalla concentrazione e questa dipendenza puo' rappresentare
una possibile fonte di errore.
(punto 43) e delle
conducibilita' equivalenti individuali degli ioni da cui e' costituito
l'elettrolita da dosare. Ricordate che, mentre i valori delle
conducibilita' ioniche individuali a diluizione infinita non
dipendono dalla concentrazione, quelle a diluizione finita
dipendono (anche se poco) dalla concentrazione e questa dipendenza puo' rappresentare
una possibile fonte di errore.
Fra le applicazioni della conduttimetria diretta possiamo ricordare il
controllo della purezza dell'acqua, inteso come verifica dell'assenza
di elettroliti disciolti. La conducibilita' specifica di un'acqua
viene confrontata con quella dell'acqua ultrapura, che e' pari a
![]() : il confronto fra il valore
misurato e quello ``teorico'' fornisce un'indicazione del grado di
purezza dell'acqua.
: il confronto fra il valore
misurato e quello ``teorico'' fornisce un'indicazione del grado di
purezza dell'acqua.
56. Nelle misure conduttimetriche indirette, cio' che conta e' la variazione di conducibilita', piu' che il suo valore effettivo: l'esempio piu' tipico e' quello delle titolazioni conduttimetriche. In completa analogia con quanto visto per la potenziometria, possiamo dire che una titolazione conduttimetrica e' una titolazione ordinaria il cui progresso viene monitorato misurando la conducibilita' della soluzione che si sta titolando in funzione del volume di titolante aggiunto.
Ovviamente, affinche' una titolazione possa essere seguita per via conduttimetrica, e' necessario che l'aggiunta della soluzione titolante provochi una variazione (piu' grande e', meglio e') della conducibilita'.
Un tipico allestimento per una titolazione conduttimetrica e' mostrato nella figura 2.5.
In pratica, la titolazione viene condotta normalmente, salvo che nella soluzione da titolare viene introdotta una cella conduttimetrica: dopo ogni aggiunta di soluzione titolante, si riporta in una tabella il corrispondente valore di conducibilita' letto sul conduttimetro. Al termine della misura, si costruisce una curva di titolazione riportando in grafico la conducibilita' in funzione del volume di titolante. Dal grafico si determina il punto finale.
Cosi' come in una titolazione potenziometrica non ha importanza
conoscere il potenziale dell'elettrodo di riferimento, in una
titolazione conduttimetrica non serve conoscere la costante di cella
![]() : l'effetto di
: l'effetto di ![]() (considerate la relazione
(considerate la relazione
![]() ) e' solo quello di ``amplificare'' o
``attenuare'' tutti i valori di conducibilita' misurati
dello stesso fattore; ma questo, come apparira' chiaro fra
breve, non ha alcuna influenza sulla determinazione del punto finale
della titolazione.
) e' solo quello di ``amplificare'' o
``attenuare'' tutti i valori di conducibilita' misurati
dello stesso fattore; ma questo, come apparira' chiaro fra
breve, non ha alcuna influenza sulla determinazione del punto finale
della titolazione.
57. Le curve di titolazione conduttimetrica sono generalmente diverse dalle tipiche curve di titolazione sigmoidi come quelle viste in potenziometria. Cio' e' dovuto alla relazione che lega la conducibilita' alla concentrazione:
Questa relazione e' lineare rispetto alla concentrazione; la relazione che lega il potenziale elettrodico alla concentrazione (la legge di Nernst) e' invece di tipo logaritmico.
Per comprendere qualitativamente le caratteristiche delle curve di titolazione conduttimetrica, consideriamo qualche esempio specifico.
58.
Abbiamo visto (tabella 2.1) che la
conducibilita' individuale degli ioni ![]() e
e ![]() sono molto
maggiori di quelle degli altri ioni. In una titolazione acido base la
concentrazione di questi ioni subisce grosse variazioni. Ne segue che
anche la conducibilita' della soluzione variera' di molto lungo il
corso della titolazione e sara' percio' adatta a monitorarne il
progresso.
sono molto
maggiori di quelle degli altri ioni. In una titolazione acido base la
concentrazione di questi ioni subisce grosse variazioni. Ne segue che
anche la conducibilita' della soluzione variera' di molto lungo il
corso della titolazione e sara' percio' adatta a monitorarne il
progresso.
Tanto per fissare le idee, consideriamo la titolazione di ![]() con
con
![]() . La tipica curva di titolazione conduttimetrica per questo
sistema e' mostrata nella figura 2.6.
. La tipica curva di titolazione conduttimetrica per questo
sistema e' mostrata nella figura 2.6.
L'interpretazione dell'andamento e' semplice.
In qualsiasi punto della titolazione, la conducibilita' della soluzione e' data dalla somma dei contributi dovuti a tutti gli ioni presenti:
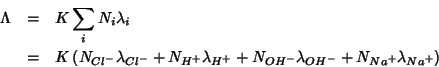
Chiediamoci ora: cosa accade man mano che aggiungiamo il titolante?
Dovreste sapere molto bene che ![]() e
e ![]() sono elettroliti
forti e percio' completamente dissociati. Prima del punto di
equivalenza, ad ogni aggiunta di soluzione titolante, gli ioni
sono elettroliti
forti e percio' completamente dissociati. Prima del punto di
equivalenza, ad ogni aggiunta di soluzione titolante, gli ioni
![]() della base neutralizzano una quantita' corrispondente di ioni
della base neutralizzano una quantita' corrispondente di ioni
![]() della soluzione di
della soluzione di ![]() . La reazione puo' essere descritta
con la seguente equazione:
. La reazione puo' essere descritta
con la seguente equazione:
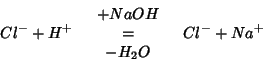
Questa equazione mette bene in evidenza i cambiamenti di
concentrazione delle specie ioniche (in definitiva, e' questo
cio' che interessa per comprendere come la conducibilita' vari in
funzione del volume di titolante aggiunto): in pratica, l'aggiunta di
![]() produce la sostituzione di ioni
produce la sostituzione di ioni ![]() ad elevata
conducibilita' (
ad elevata
conducibilita' (
![]() ) con ioni
) con ioni ![]() a conducibilita' inferiore (
a conducibilita' inferiore (
![]() ). In
altre parole,
). In
altre parole, ![]() diminuisce e
diminuisce e ![]() aumenta. Pero',
siccome
aumenta. Pero',
siccome ![]() e' maggiore di
e' maggiore di
![]() , la
diminuzione del contributo degli ioni
, la
diminuzione del contributo degli ioni ![]() alla conducibilita'
totale della soluzione non e' compensata dall'aumento del contributo
dovuto agli ioni
alla conducibilita'
totale della soluzione non e' compensata dall'aumento del contributo
dovuto agli ioni ![]() e quindi si osserva un calo di
conducibilita'. Questo calo e' proporzionale (a parte una piccola
complicazione che vedremo fra un momento) al volume di soluzione
titolante aggiunto e quindi l'andamento della curva di titolazione
prima del punto finale sara' una retta con pendenza negativa.
e quindi si osserva un calo di
conducibilita'. Questo calo e' proporzionale (a parte una piccola
complicazione che vedremo fra un momento) al volume di soluzione
titolante aggiunto e quindi l'andamento della curva di titolazione
prima del punto finale sara' una retta con pendenza negativa.
Dopo il punto finale, l'idrossido di sodio che si aggiunge non
viene piu' neutralizzato da ![]() , per cui in soluzione si ha un
aumento della concentrazione di ioni
, per cui in soluzione si ha un
aumento della concentrazione di ioni ![]() e
e ![]() . Se guardate
l'espressione che abbiamo scritto sopra per la conducibilita' vi
rendete conto facilmente che cio' comporta un aumento di
conducibilita', che sara' di nuovo proporzionale al volume di
soluzione titolante aggiunto. L'andamento della curva di titolazione
dopo il punto finale sara' pertanto quello di una retta con pendenza
positiva.
. Se guardate
l'espressione che abbiamo scritto sopra per la conducibilita' vi
rendete conto facilmente che cio' comporta un aumento di
conducibilita', che sara' di nuovo proporzionale al volume di
soluzione titolante aggiunto. L'andamento della curva di titolazione
dopo il punto finale sara' pertanto quello di una retta con pendenza
positiva.
Il punto finale della titolazione viene determinato semplicemente dall'intersezione dei due tratti rettilinei ottenuti.
59. Prima di analizzare qualche altro esempio, facciamo alcune considerazioni generali sulle condizioni che devono essere verificate affinche' i due rami di curva che si ottengono siano effettivamente rettilinei.
e questa non e' affatto una relazione lineare!
Tuttavia, la relazione tende a diventare lineare se ![]() . In
tal caso, infatti,
. In
tal caso, infatti, ![]() si puo' trascurare al denominatore ottenendo:
si puo' trascurare al denominatore ottenendo:
che e' una funzione lineare di ![]() .
.
Da quanto detto concludiamo che si otterra' una relazione lineare fra
la conducibilita' misurata e il volume di soluzione titolante aggiunto
solo se tale volume risulta sempre trascurabile rispetto al volume
iniziale della soluzione da titolare. In altri termini, bisogna fare
in modo che la diluizione della soluzione da titolare prodotta
dall'aggiunta della soluzione titolante sia trascurabile. Questo
requisito si realizza facilmente utilizzando una soluzione titolante
molto concentrata e diluendo la soluzione da titolare ad un volume
piu' grande possibile. Per esempio, se titoliamo ![]() di
di ![]()
![]() con una soluzione di
con una soluzione di ![]()
![]() ,
il volume al punto finale e' solo di
,
il volume al punto finale e' solo di ![]() , il che significa che
l'aggiunta del titolante provoca una diluizione di
, il che significa che
l'aggiunta del titolante provoca una diluizione di ![]() .
.
Gli effetti di non linearita' dovuti all'incompletezza della reazione analitica sono spesso molto evidenti. Ad esempio, nella titolazione di un acido debole con una base forte, il primo tratto di curva, quello precedente il punto finale, appare incurvato proprio a causa del minor spostamento dell'equilibrio a favore dei prodotti (figura 2.7).
Per le stesse ragioni, molto spesso si osserva un caratteristico ``arrotondamento'' della curva di titolazione in un intorno del punto finale. Possiamo spiegarci questo effetto nel modo seguente: molto prima del punto finale la concentrazione della specie da titolare e' in largo eccesso rispetto a quella del titolante; molto dopo il punto finale la situazione e' invertita. In ogni caso, l'eccesso di uno dei due reagenti spinge verso destra l'equilibrio della reazione. Cio' non e' piu' vero in vicinanza del punto finale, in cui nessuno dei due reagenti si trova in eccesso rispetto all'altro.
Per questo motivo, per la determinazione del punto finale, solitamente conviene estrapolare i tratti lineari della curva di titolazione piu' lontani dal punto finale.
e' rigorosamente valida solo a diluizione infinita
(punto 50). A concentrazioni ordinarie, le
conducibilita' ioniche individuali ![]() dipendono
dalla concentrazione (in modo non semplice). Questa potrebbe essere
un'ulteriore causa di non linearita' (in un certo senso diversa dai
due fattori visti prima: in questo caso e' la linearita' fra
dipendono
dalla concentrazione (in modo non semplice). Questa potrebbe essere
un'ulteriore causa di non linearita' (in un certo senso diversa dai
due fattori visti prima: in questo caso e' la linearita' fra
![]() e le concentrazioni che viene minacciata). Fortunatamente,
nell'intervallo di concentrazioni generalmente impiegate per le
titolazioni conduttimetriche, la dipendenza dei
e le concentrazioni che viene minacciata). Fortunatamente,
nell'intervallo di concentrazioni generalmente impiegate per le
titolazioni conduttimetriche, la dipendenza dei ![]() dalla
concentrazione e' quasi sempre trascurabile.
dalla
concentrazione e' quasi sempre trascurabile.
60. Anche le titolazioni in cui si forma un sale poco solubile possono essere seguite convenientemente per via conduttimetrica.
Consideriamo come esempio la titolazione di ![]() con una
soluzione standard di
con una
soluzione standard di ![]() .
.
Sappiamo che sia ![]() che
che ![]() sono completamente
dissociati; ad ogni aggiunta di
sono completamente
dissociati; ad ogni aggiunta di ![]() , gli ioni
, gli ioni ![]() reagiscono
con gli ioni
reagiscono
con gli ioni ![]() presenti in soluzione per dare
presenti in soluzione per dare ![]() insolubile, che precipita.
insolubile, che precipita.
La conducibilita' della soluzione e' data da:
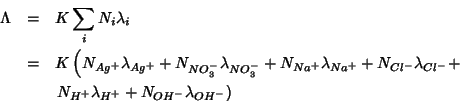
Notate che, anche se gli ioni ![]() e
e ![]() non partecipano alla
reazione analitica, la conducibilita' della soluzione risente del loro
contributo. Possiamo tuttavia assumere che la loro concentrazione
rimanga costante lungo tutta la titolazione, e che pertanto lo stesso valga
per i termini
non partecipano alla
reazione analitica, la conducibilita' della soluzione risente del loro
contributo. Possiamo tuttavia assumere che la loro concentrazione
rimanga costante lungo tutta la titolazione, e che pertanto lo stesso valga
per i termini
![]() e
e
![]() .
.
Analogamente a quanto visto prima per la titolazione acido base, la reazione analitica viene convenientemente descritta con:
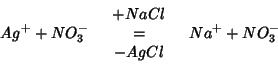
L'equazione su scritta mette in evidenza che l'effetto dell'aggiunta
del titolante e' quello di sostituire ioni ![]() (
(
![]() ) con ioni
) con ioni ![]() (
(
![]() ). Ormai dovrebbe essere
chiaro che la conseguenza di cio' e' un calo di conducibilita'
proporzionale al volume di titolante (entro i limiti discussi al
punto 59) prima del punto finale.
). Ormai dovrebbe essere
chiaro che la conseguenza di cio' e' un calo di conducibilita'
proporzionale al volume di titolante (entro i limiti discussi al
punto 59) prima del punto finale.
Dopo il punto finale, il ![]() aggiunto non reagisce
ulteriormente, ma rimane in soluzione come tale. Si avra' percio' un
aumento regolare di
aggiunto non reagisce
ulteriormente, ma rimane in soluzione come tale. Si avra' percio' un
aumento regolare di ![]() e
e ![]() che determinera' un
corrispondente aumento della conducibilita' proporzionale al
volume di titolante. Una curva di titolazione ``reale'' per questo
sistema e' mostrata nella figura 2.8.
che determinera' un
corrispondente aumento della conducibilita' proporzionale al
volume di titolante. Una curva di titolazione ``reale'' per questo
sistema e' mostrata nella figura 2.8.
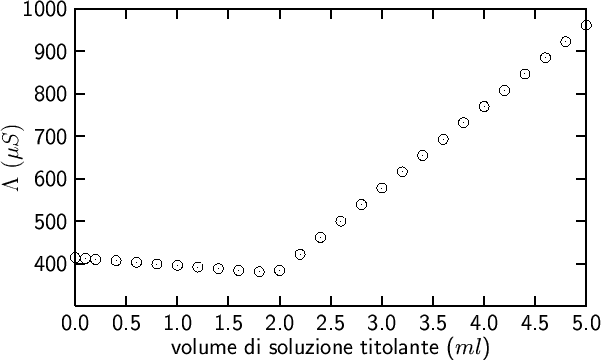 |
61. In generale, si puo' seguire una titolazione per via conduttimetrica in tutti i casi in cui la reazione analitica provoca un cambiamento significativo della conducibilita' della soluzione. E' questo il caso anche di alcune titolazioni complessometriche.
Ad esempio, alcuni ioni trivalenti della serie dei lantanidi possono
essere determinati mediante una retro titolazione con EDTA (dovreste
sapere gia' tutto sulle titolazioni con EDTA!). Alla soluzione
di partenza contenente il catione da determinare, che deve essere
tenuta ad un ![]() sufficientemente basso per impedire la
precipitazione del relativo idrossido, viene aggiunto un eccesso
noto di complessante: una parte di esso si lega con il catione
trivalente e il resto rimane libero in soluzione. Successivamente il
sufficientemente basso per impedire la
precipitazione del relativo idrossido, viene aggiunto un eccesso
noto di complessante: una parte di esso si lega con il catione
trivalente e il resto rimane libero in soluzione. Successivamente il
![]() viene portato a
viene portato a ![]() (ora non c'e' piu' pericolo che
precipiti l'idrossido poiche' il complesso EDTA-catione e' piu'
stabile) e l' eccesso di EDTA viene titolato con una soluzione
standard di
(ora non c'e' piu' pericolo che
precipiti l'idrossido poiche' il complesso EDTA-catione e' piu'
stabile) e l' eccesso di EDTA viene titolato con una soluzione
standard di ![]() : dal punto finale della titolazione si ricava
l'eccesso di EDTA e quindi, per differenza rispetto alla quantita'
totale aggiunta inizialmente, si risale alla quantita' del catione
trivalente.
: dal punto finale della titolazione si ricava
l'eccesso di EDTA e quindi, per differenza rispetto alla quantita'
totale aggiunta inizialmente, si risale alla quantita' del catione
trivalente.
Un esempio reale di questa titolazione e' mostrato nella figura 2.9.
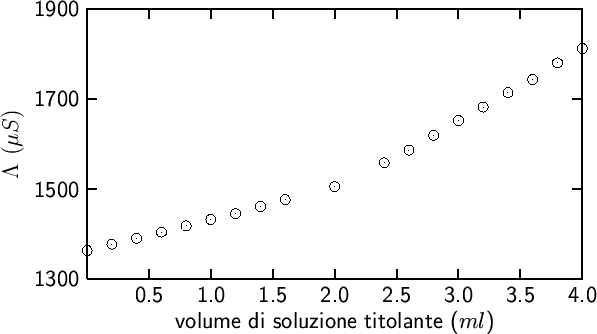 |
Per cercare di comprendere come varia la conducibilita' della
soluzione durante la titolazione facciamo l'inventario delle specie
ioniche presenti. Siccome siamo in acqua, ci sono gli ioni ![]() e
e
![]() , la cui concentrazione puo' essere assunta costante lungo
tutta la titolazione. Abbiamo poi il complesso fra il catione
trivalente (supponiamo sia
, la cui concentrazione puo' essere assunta costante lungo
tutta la titolazione. Abbiamo poi il complesso fra il catione
trivalente (supponiamo sia ![]() , tanto per fissare le idee) e
l'EDTA:
, tanto per fissare le idee) e
l'EDTA:
![]() ; anche questo termine rimane costante
(ricordate che titoliamo l' eccesso di EDTA). Al
; anche questo termine rimane costante
(ricordate che titoliamo l' eccesso di EDTA). Al ![]() a cui si
effettua la titolazione, possiamo assumere con buona approssimazione
che l'EDTA libero (cioe' quello in eccesso, non legato al catione
trivalente), si trovi praticamente tutto sotto forma di anione
tetravalente
a cui si
effettua la titolazione, possiamo assumere con buona approssimazione
che l'EDTA libero (cioe' quello in eccesso, non legato al catione
trivalente), si trovi praticamente tutto sotto forma di anione
tetravalente ![]() . Ci sono poi gli ioni provenienti dal
titolante:
. Ci sono poi gli ioni provenienti dal
titolante: ![]() e
e ![]() . Infine, ad ogni aggiunta di
titolante, ioni
. Infine, ad ogni aggiunta di
titolante, ioni ![]() si legano a ioni
si legano a ioni ![]() per formare
corrispondenti ioni
per formare
corrispondenti ioni
![]() .
.
La conducibilita' del sistema e' la somma dei contributi dovuti a tutte queste specie ioniche:
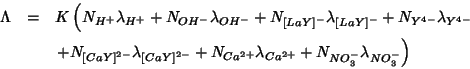
Allora, prima del punto di equivalenza, l'aggiunta di
![]() e' convenientemente descritta dalla seguente equazione:
e' convenientemente descritta dalla seguente equazione:
Ci sono due effetti: ioni ![]() vengono sostituiti da specie
complesse
vengono sostituiti da specie
complesse
![]() , e questo porta un contributo
negativo alla conducibilita' (cioe' da solo tenderebbe a farla
diminuire poiche' riduce il numero di cariche sullo ione
, e questo porta un contributo
negativo alla conducibilita' (cioe' da solo tenderebbe a farla
diminuire poiche' riduce il numero di cariche sullo ione ![]() );
tuttavia, il secondo effetto e' un aumento netto della concentrazione
di ioni
);
tuttavia, il secondo effetto e' un aumento netto della concentrazione
di ioni ![]() . Siccome si ha
. Siccome si ha
![]() , l'effetto
globale e' quello di un aumento della conducibilita' (notate la
differenza coi casi precedenti, in cui prima del punto finale si aveva
un calo di conducibilita').
, l'effetto
globale e' quello di un aumento della conducibilita' (notate la
differenza coi casi precedenti, in cui prima del punto finale si aveva
un calo di conducibilita').
Dopo il punto finale, il ![]() aggiunto si accumula in
soluzione perche' l'EDTA libero e' terminato (naturalmente il
complesso
aggiunto si accumula in
soluzione perche' l'EDTA libero e' terminato (naturalmente il
complesso
![]() e' piu' stabile del complesso
e' piu' stabile del complesso
![]() e quindi non si ha la reazione di
spostamento:
e quindi non si ha la reazione di
spostamento:
![]() ,
altrimenti questa titolazione non si potrebbe fare!). Se ne deduce che
la conducibilita' continua ad aumentare. Tuttavia, a causa del
contributo addizionale dovuto agli ioni
,
altrimenti questa titolazione non si potrebbe fare!). Se ne deduce che
la conducibilita' continua ad aumentare. Tuttavia, a causa del
contributo addizionale dovuto agli ioni ![]() , l'aumento della
conducibilita' avra' ora una pendenza maggiore (guardate la
figura 2.9).
, l'aumento della
conducibilita' avra' ora una pendenza maggiore (guardate la
figura 2.9).
Estrapolando i due tratti lineari ottenuti e' possibile determinare abbastanza agevolmente il punto finale.