Fra i vari elettrodi indicatori, particolare importanza riveste l'elettrodo a vetro. Tale
elettrodo e' quasi universalmente utilizzato per la misura del ![]() . Inoltre, dipendentemente dal tipo di vetro, e' possibile trovare in commercio elettrodi sensibili alla
concentrazione di ioni diversi dal protone, come ad esempio
. Inoltre, dipendentemente dal tipo di vetro, e' possibile trovare in commercio elettrodi sensibili alla
concentrazione di ioni diversi dal protone, come ad esempio
![]() .
.
Il funzionamento dell'elettrodo a vetro puo' essere illustrato con la cella mostrata in figura 1.10
Cio' che viene chiamato elettrodo a vetro e' rappresentato dalla meta'
di destra della cella, membrana di vetro compresa. Abbiamo dunque un
elettrodo di riferimento (generalmente ![]() ) immerso in una
soluzione ad attivita' protonica costante (generalmente
) immerso in una
soluzione ad attivita' protonica costante (generalmente
![]() ) e separata dalla soluzione oggetto di misura
(soluzione test) mediante una membrana di vetro. Attraverso tale
membrana si genera una differenza di potenziale che dipende
dall'attivita' degli ioni
) e separata dalla soluzione oggetto di misura
(soluzione test) mediante una membrana di vetro. Attraverso tale
membrana si genera una differenza di potenziale che dipende
dall'attivita' degli ioni ![]() nella soluzione test (vedere
oltre). Se in quest'ultima e' immerso un secondo elettrodo di
riferimento, allora la differenza di potenziale della cella e' data
da:
nella soluzione test (vedere
oltre). Se in quest'ultima e' immerso un secondo elettrodo di
riferimento, allora la differenza di potenziale della cella e' data
da:
dove ![]() ed
ed ![]() sono i potenziali elettrodici dei due elettrodi
di riferimento,
sono i potenziali elettrodici dei due elettrodi
di riferimento, ![]() e' il potenziale di giunto eventualmente
presente all'interfaccia fra la soluzione test e l'elettrodo di
riferimento
e' il potenziale di giunto eventualmente
presente all'interfaccia fra la soluzione test e l'elettrodo di
riferimento ![]() ,
, ![]() e' la differenza di potenziale attraverso la
membrana di vetro.
e' la differenza di potenziale attraverso la
membrana di vetro.
Nell'espressione sopra scritta, ![]() ed
ed ![]() sono costanti, in
quanto potenziali elettrodici di elettrodi di riferimento. Quando il
sono costanti, in
quanto potenziali elettrodici di elettrodi di riferimento. Quando il
![]() della soluzione test cambia, in generale cambieranno sia
della soluzione test cambia, in generale cambieranno sia
![]() che
che ![]() . Tuttavia, le variazioni di
. Tuttavia, le variazioni di ![]() sono di
solito molto piccole, per cui le variazioni di differenza di
potenziale al variare del
sono di
solito molto piccole, per cui le variazioni di differenza di
potenziale al variare del ![]() nella soluzione test sono dovute
essenzialmente alle variazioni di
nella soluzione test sono dovute
essenzialmente alle variazioni di ![]() . Si comprende dunque
come la misura della differenza di potenziale della cella su mostrata
fornisce una misura del
. Si comprende dunque
come la misura della differenza di potenziale della cella su mostrata
fornisce una misura del ![]() della soluzione test.
della soluzione test.
E' opportuno richiamare l'attenzione sul fatto che l'elettrodo a vetro, contrariamente a cio' che induce a pensare il suo nome, non e' un elettrodo indicatore vero e proprio (per lo meno non nel senso prima specificato): la differenza di potenziale legata all'attivita' protonica e' piu' simile ad un potenziale di giunto che ad un potenziale elettrodico.
Viene di seguito illustrata in modo qualitativo l'origine della
differenza di potenziale ![]() su cui si basa l'elettrodo a vetro. Un
ingrandimento della membrana di vetro appare come in
figura 1.11.
su cui si basa l'elettrodo a vetro. Un
ingrandimento della membrana di vetro appare come in
figura 1.11.
Quando la membrana di vetro e' a contatto con due soluzioni acquose da
entrambi i lati, le due facce vengono idratate per una profondita' di
circa ![]() . Nei due strati idratati si stabilisce un
equilibrio di adsorbimento/desorbimento degli ioni
. Nei due strati idratati si stabilisce un
equilibrio di adsorbimento/desorbimento degli ioni ![]() , presenti
nella soluzione acquosa, e degli ioni
, presenti
nella soluzione acquosa, e degli ioni ![]() o
o ![]() che
occupano le posizioni reticolari dello scheletro di silicato
costituente la membrana. E' questo equilibrio che determina lo
stabilirsi di una differenza di potenziale fra ciascuna faccia della
membrana e la soluzione con cui essa e' a contatto.
che
occupano le posizioni reticolari dello scheletro di silicato
costituente la membrana. E' questo equilibrio che determina lo
stabilirsi di una differenza di potenziale fra ciascuna faccia della
membrana e la soluzione con cui essa e' a contatto.
Va osservato che la membrana deve assicurare il passaggio di corrente
elettrica: nella parte non idratata (``secca''), la conducibilita' e'
assicurata dalla migrazione interstiziale dei cationi presenti nel
vetro (![]() ,
, ![]() etc).
etc).
La differenza di potenziale fra la faccia della membrana a contatto
con la soluzione di ![]() e quest'ultima e' sempre costante
(perche' la soluzione e' sempre la stessa). Per contro, la differenza
di potenziale fra l'altra faccia della membrana e la soluzione test
dipendera' dal
e quest'ultima e' sempre costante
(perche' la soluzione e' sempre la stessa). Per contro, la differenza
di potenziale fra l'altra faccia della membrana e la soluzione test
dipendera' dal ![]() della soluzione test, perche' l'equilibrio di
adsorbimento degli ioni
della soluzione test, perche' l'equilibrio di
adsorbimento degli ioni ![]() dipende dalla loro attivita' in
soluzione. Si trova che tale differenza di potenziale dipende
linearmente dal
dipende dalla loro attivita' in
soluzione. Si trova che tale differenza di potenziale dipende
linearmente dal ![]() della soluzione test tramite un'espressione
formalmente identica a quella della legge di Nernst. Ne segue che la
differenza di potenziale attraverso l'intera membrana, cioe'
della soluzione test tramite un'espressione
formalmente identica a quella della legge di Nernst. Ne segue che la
differenza di potenziale attraverso l'intera membrana, cioe' ![]() , e'
data da:
, e'
data da:
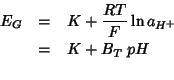
dove ![]() e
e ![]() sono costanti (ma
sono costanti (ma ![]() dipende dalla temperatura).
dipende dalla temperatura).
Risalendo indietro, si conclude che l'intera differenza di potenziale della cella e' una funzione lineare del pH della soluzione test:
(![]() contiene
contiene ![]() e tutti gli altri termini costanti).
e tutti gli altri termini costanti).
Verranno di seguito riportate alcune considerazioni pratiche riguardanti l'uso degli elettrodi a vetro.
Gli elettrodi commerciali sono in genere molto compatti. I piu'
pratici sono i cosiddetti elettrodi combinati, che contengono la
soluzione di ![]() , la membrana di vetro e i due elettrodi di
riferimento in un unico stilo (figura 1.12).
, la membrana di vetro e i due elettrodi di
riferimento in un unico stilo (figura 1.12).
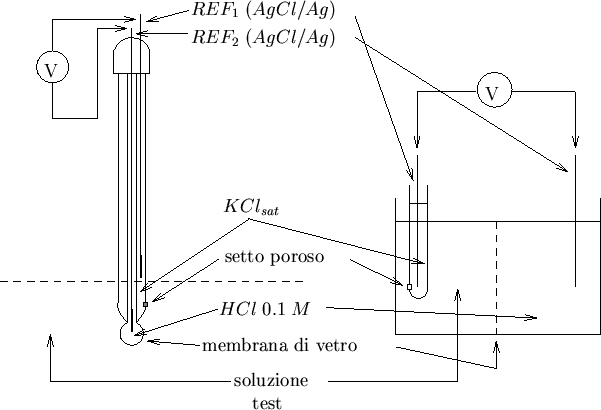 |
Non dovrebbe essere difflcile riconoscere l'esatta corrispondenza
dell'assemblaggio mostrato con lo schema di principio illustrato
prima. La misura della differenza di potenziale della cella viene
eseguita con un voltmetro ad elevata impedenza di ingresso (cio' per
fare in modo che la corrente circolante nella cella durante la misure
sia di intensita' trascurabile). Nel caso specifico della misura del
![]() , esistono strumenti, detti pH-metri, in grado di fornire la
lettura direttamente in unita' di pH.
, esistono strumenti, detti pH-metri, in grado di fornire la
lettura direttamente in unita' di pH.
Ciascun elettrodo a vetro e' caratterizzato da una propria risposta:
Di conseguenza, prima di effettuare una misura, il sistema costituito
dal pH-metro e dall'elettrodo va tarato con delle soluzioni a ![]() noto. In genere gli strumenti consentono di effettuare una taratura
con due soluzioni tampone. La taratura si esegue dapprima calibrando
il pH-metro sulla prima soluzione per mezzo di una manopola
potenziometrica di regolazione. A questo punto si estrae l'elettrodo
dalla soluzione, lo si lava accuratamente con acqua distillata, lo si
immerge nella seconda soluzione e si calibra lo strumento sul secondo
valore di
noto. In genere gli strumenti consentono di effettuare una taratura
con due soluzioni tampone. La taratura si esegue dapprima calibrando
il pH-metro sulla prima soluzione per mezzo di una manopola
potenziometrica di regolazione. A questo punto si estrae l'elettrodo
dalla soluzione, lo si lava accuratamente con acqua distillata, lo si
immerge nella seconda soluzione e si calibra lo strumento sul secondo
valore di ![]() mediante un'altra manopola potenziometrica, che in
genere viene detta ``slope control''. Si ricontrolla infine la lettura
sulla prima soluzione e, se risulta corretta, si puo' assumere che lo
strumento fornisca letture attendibili di
mediante un'altra manopola potenziometrica, che in
genere viene detta ``slope control''. Si ricontrolla infine la lettura
sulla prima soluzione e, se risulta corretta, si puo' assumere che lo
strumento fornisca letture attendibili di ![]() nell'intervallo
determinato dalle due soluzioni tampone. Va aggiunto che la maggior
parte dei pH-metri prevede anche la possibilita' di tenere conto della
temperatura della soluzione test, che in questo caso va misurata
preventivamente (si ricordi che il parametro
nell'intervallo
determinato dalle due soluzioni tampone. Va aggiunto che la maggior
parte dei pH-metri prevede anche la possibilita' di tenere conto della
temperatura della soluzione test, che in questo caso va misurata
preventivamente (si ricordi che il parametro ![]() dipende dalla
temperatura).
dipende dalla
temperatura).
Diciamo ancora qualcosa sulle possibili fonti di errore connesse all'impiego dell'elettrodo a vetro.
Tale definizione risulta operativamente scomoda, in quanto qualsiasi
metodo di determinazione del ![]() (potenziometrico e non) e'
sensibile all'attivita' degli ioni
(potenziometrico e non) e'
sensibile all'attivita' degli ioni ![]() piuttosto che alla loro
concentrazione.
piuttosto che alla loro
concentrazione.
Si e' cosi' passati successivamente ad una definizione in termini di attivita':
Va notato che neppure questa definizione e' priva di inconsistenza
quando la si voglia metter in atto. Infatti, qualsiasi cella si
impieghi per misurare il ![]() di una soluzione, questa contiene dei
potenziali di giunto che rappresentano una inevitabile fonte di
incertezza.
di una soluzione, questa contiene dei
potenziali di giunto che rappresentano una inevitabile fonte di
incertezza.
Per minimizzare quest'ultima, l'attuale definizione di pH e' di tipo
``operativo''. La differenza fra il ![]() di una soluzione
di una soluzione ![]() e
quello di una soluzione nota
e
quello di una soluzione nota ![]() , alla stessa temperatura, con lo
stesso elettrodo di riferimento e lo stesso elettrodo a idrogeno (con
, alla stessa temperatura, con lo
stesso elettrodo di riferimento e lo stesso elettrodo a idrogeno (con
![]() ) per la misura dell'attivita' degli ioni
) per la misura dell'attivita' degli ioni
![]() , e' data da:
, e' data da:
dove ![]() e' la differenza di potenziale della cella quando
l'elettrodo a idrogeno e' immerso nella soluzione
e' la differenza di potenziale della cella quando
l'elettrodo a idrogeno e' immerso nella soluzione ![]() , mentre
, mentre
![]() e' la differenza di potenziale della cella quando
l'elettrodo a idrogeno e' immerso nella soluzione
e' la differenza di potenziale della cella quando
l'elettrodo a idrogeno e' immerso nella soluzione ![]() (il resto della
cella rimanendo esattamente lo stesso).
(il resto della
cella rimanendo esattamente lo stesso).
Indicando con ![]() il potenziale (costante) del riferimento, la
differenza di potenziale delle due celle puo' essere scritta come
segue:
il potenziale (costante) del riferimento, la
differenza di potenziale delle due celle puo' essere scritta come
segue:
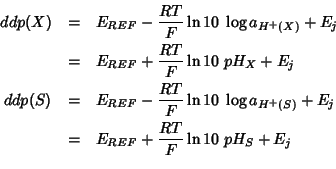
(si noti che la differenza di potenziale viene scritta come differenza
fra il potenziale dell'elettrodo di riferimento e quello
dell'elettrodo a idrogeno, e non viceversa: in tal modo, a differenza
di potenziale maggiore corrisponde ![]() maggiore)
maggiore)
Sottraendo membro a membro le due equazioni su scritte si ottiene la
relazione finale. Si osservi tuttavia come la definizione assuma che
il potenziale di giunto ![]() rimanga costante nelle due misure.
rimanga costante nelle due misure.
La definizione viene completata dalla specifica della soluzione ![]() e
del
e
del ![]() ad essa corrispondente. La soluzione
ad essa corrispondente. La soluzione ![]() e' una soluzione
e' una soluzione
![]() di ftalato acido di potassio. Il
di ftalato acido di potassio. Il ![]() di tale soluzione a
di tale soluzione a
![]() e' definito pari a
e' definito pari a ![]() . Accanto a questa soluzione,
vengono definite altre soluzioni ``primarie'', che coprono il campo di
. Accanto a questa soluzione,
vengono definite altre soluzioni ``primarie'', che coprono il campo di
![]() compreso fra
compreso fra ![]() e
e ![]() . Esistono infine ulteriori standard
``operativi'' che estendono il campo di
. Esistono infine ulteriori standard
``operativi'' che estendono il campo di ![]() da
da ![]() a
a ![]() .
.
Si puo' infine osservare che per la maggior parte delle applicazioni
e' ampiamente sufficiente il ricorso a soluzioni tampone di ![]() noto
reperibili in commercio.
noto
reperibili in commercio.