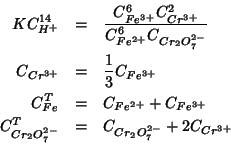
Il sistema e' completamente descritto dalle seguenti equazioni:
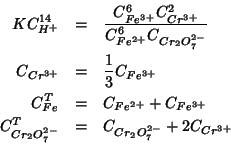
ovvero, introducendo la variabile ![]() ed esprimendo
ed esprimendo ![]() in
funzione dei potenziali standard:
in
funzione dei potenziali standard:
L'equazione (C.10) esprime la condizione di equilibrio per
la reazione redox; l'equazione (C.11) esprime il vincolo
imposto dalla stechiometria; l'equazione (C.12) esprime la
conservazione della quantita' totale di specie ![]() ; l'equazione
(C.13) esprime la conservazione della quantita' totale di
specie
; l'equazione
(C.13) esprime la conservazione della quantita' totale di
specie ![]() .
.
A questo punto, per ogni valore di ![]() , il sistema puo' essere
risolto (assegnati i valori ai parametri) per via numerica, ottenendo
il valore delle quattro concentrazioni incognite. Queste, a loro
volta, vengono introdotte nella equazione (C.7) o
(C.8) da cui si ottiene la differenza di potenziale.
, il sistema puo' essere
risolto (assegnati i valori ai parametri) per via numerica, ottenendo
il valore delle quattro concentrazioni incognite. Queste, a loro
volta, vengono introdotte nella equazione (C.7) o
(C.8) da cui si ottiene la differenza di potenziale.
Un esempio di calcolo e' mostrato nella figura C.1.