Nonostante l'acido borico sia molto debole (![]() ), puo' venire
dosato mediante titolazione conduttimetrica con una
soluzione standard di
), puo' venire
dosato mediante titolazione conduttimetrica con una
soluzione standard di ![]() .
.
Come accennato in precedenza, per migliorare la determinazione del
punto finale, si puo' salificare l'acido con un eccesso di ![]() prima di iniziare la titolazione. L'effetto dell'aggiunta di un
eccesso di
prima di iniziare la titolazione. L'effetto dell'aggiunta di un
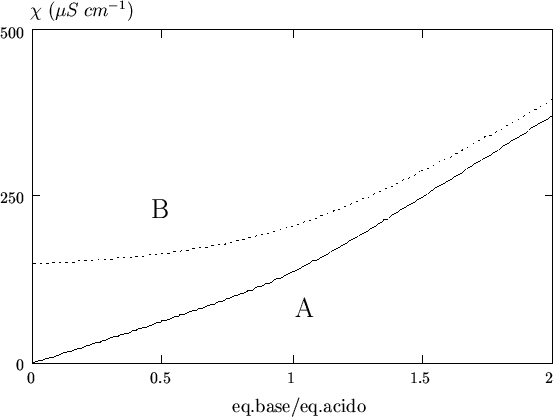
eccesso di ![]() e' mostrato nella figura 3.17. Si puo'
osservare come, contrariamente a quanto ci si potrebbe aspettare sulla
base di quanto detto nella sezione (3.4.3.3), nel primo tratto
della curva la conducibilita' non diminuisce, ma aumenta. Cio' si
riscontra non solo col calcolo, ma anche nella pratica ed e'
probabilmente dovuto ad una non completa salificazione dell'acido
borico, a causa della sua costante di ionizzazione molto bassa. Nella
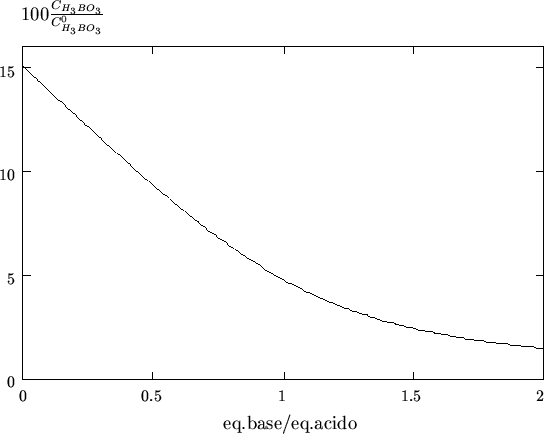
figura 3.18 e' riportata la concentrazione di acido borico
indissociato nel corso della titolazione. Si puo' vedere come,
nonostante l'aggiunta dell'ammoniaca, una frazione apprezzabile di
acido borico non viene neutralizzata. Di conseguenza,
e' mostrato nella figura 3.17. Si puo'
osservare come, contrariamente a quanto ci si potrebbe aspettare sulla
base di quanto detto nella sezione (3.4.3.3), nel primo tratto
della curva la conducibilita' non diminuisce, ma aumenta. Cio' si
riscontra non solo col calcolo, ma anche nella pratica ed e'
probabilmente dovuto ad una non completa salificazione dell'acido
borico, a causa della sua costante di ionizzazione molto bassa. Nella
figura 3.18 e' riportata la concentrazione di acido borico
indissociato nel corso della titolazione. Si puo' vedere come,
nonostante l'aggiunta dell'ammoniaca, una frazione apprezzabile di
acido borico non viene neutralizzata. Di conseguenza, ![]() reagisce
sia con lo ione ammonio che con
reagisce
sia con lo ione ammonio che con ![]() :
:
 |
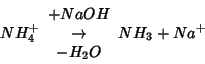
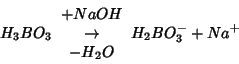
La prima reazione tende a far diminuire la conducibilita' , ma la seconda tende a farla aumentare: cio' che si osserva e' quindi il compromesso risultante da questi due effetti contrapposti.
 |
Per limitare gli effetti della diluizione sulla conducibilita'
misurata nel corso della titolazione, il volume totale di titolante
impiegato deve essere trascurabile rispetto al volume iniziale della
soluzione da titolare. A tale scopo la concentrazione della base e'
generalmente elevata (![]() ), in modo che il volume totale
impiegato risulti pari a
), in modo che il volume totale
impiegato risulti pari a ![]() .
.
La curva di titolazione viene costruita riportando i valori di conducibilita' misurati in funzione del volume di titolante aggiunto.
Il punto finale viene determinato dall'intersezione delle due rette che si ottengono approssimando i due tratti lineari della curva (figura 3.19).
La titolazione di una soluzione
contenente ![]() con una soluzione di
con una soluzione di ![]() si presta molto
bene ad essere seguita per via conduttimetrica.
si presta molto
bene ad essere seguita per via conduttimetrica.
Come gia' detto in generale, e' desiderabile che le veriazioni di
conducibilita' osservate siano dovute solo alla reazione analitica e
non alle variazioni di concentrazione dovute alla diluizione: per
questo motivo la concentrazione della soluzione titolante di ![]() ed il volume della soluzione da titolare sono generalmente elevati.
ed il volume della soluzione da titolare sono generalmente elevati.
La curva di titolazione viene costruita riportando i valori di conducibilita' misurati in funzione del volume di titolante aggiunto.
Il punto finale viene determinato dall'intersezione dei due tratti lineari della curva (figura 3.20).