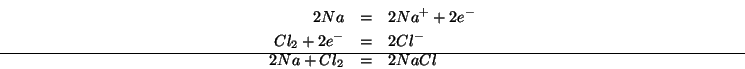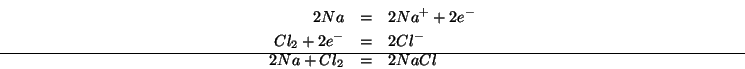Next: Slide n. 74: una
Up: Slides delle lezioni del
Previous: Slide n. 72: nelle
- Una perdita di elettroni si definisce ossidazione,
mentre un acquisto di elettroni si definisce
riduzione. Ossidazione e riduzione sono sempre associate in
una reazione redox: cioe' se qualche specie si ossida (cede
elettroni), deve essere presente qualche altra specie che si
riduce (acquista gli elettroni ceduti dalla specie che si e'
ossidata).
- La specie che si ossida viene percio' detta riducente,
perche', ossidandosi, riduce qualche altra specie; analogamente, la
specie che si riduce viene detta ossidante, perche',
riducendosi, ossida qualche altra specie.
- Ogni reazione redox puo' essere scissa
nella somma di due semireazioni: una semireazione di
ossidazione e una semireazione di riduzione.
Ad esempio:
- Come vedremo parlando di elettrochimica, la
semireazione non e' solo un formalismo valido per il bilanciamento
delle reazioni redox, ma puo' divenire un processo reale, nel senso
che e' possibile scindere una reazione redox in due semireazioni
componenti anche in pratica, ad esempio in una cella elettrochimica.
- Una semireazione puo' avvenire sia in un senso che nel senso
opposto. Ad esempio,
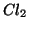 si riduce a ione
si riduce a ione
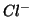 acquistando
acquistando 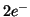 ; tuttavia, anche il contrario
puo' avvenire:
; tuttavia, anche il contrario
puo' avvenire: 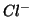 puo' ossidarsi perdendo
puo' ossidarsi perdendo 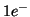 e
producendo
e
producendo 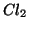 . Si dice allora che
. Si dice allora che 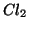 e
e 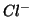 formano una coppia redox:
formano una coppia redox: 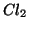 e' la forma ossidata
della coppia redox, mentre
e' la forma ossidata
della coppia redox, mentre 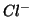 e' la forma ridotta
e' la forma ridotta
- Una semireazione interconverte i due membri di una coppia redox:
la forma ossidata (cui corrisponde un numero di ossidazione maggiore)
si converte nella forma ridotta (cui corrisponde un numero di
ossidazione minore) per acquisto di elettroni e viceversa.




Next: Slide n. 74: una
Up: Slides delle lezioni del
Previous: Slide n. 72: nelle