Assumiamo che la formula sia: ![]() . Applicando quanto visto
si ha:
. Applicando quanto visto
si ha:
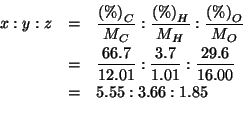
Questo significa che nella molecola del composto ![]()
![]() e
e ![]() sono combinati nel rapporto
sono combinati nel rapporto
![]() . La formula empirica
potrebbe essere scritta come:
. La formula empirica
potrebbe essere scritta come:
![]() . Tuttavia,
siccome non ha senso indicare un numero di atomi non intero, si devono
trasformare gli indici in numeri interi e primi fra loro. Questo puo'
essere fatto dividendoli tutti per il piu' piccolo di essi:
. Tuttavia,
siccome non ha senso indicare un numero di atomi non intero, si devono
trasformare gli indici in numeri interi e primi fra loro. Questo puo'
essere fatto dividendoli tutti per il piu' piccolo di essi:
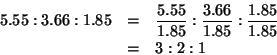
La formula empirica del composto e' dunque: ![]()