



Next: Slide n. 372: espansione
Up: Slides delle lezioni del
Previous: Slide n. 370: solubilita'
L'entropia e l'energia libera.
- Parlando dell'equilibrio chimico abbiamo visto che alcune
reazioni sono molto spostate verso destra, mentre altre lo sono
pochissimo. In generale, ha molta importanza sapere se un certo
processo ha tendenza ad avvenire o meno: serve cioe' un
criterio di spontaneita'.
- Per sistemi meccanici semplici, tale criterio e' quello del
raggiungimento di uno stato di minima energia: un corpo sospeso
lasciato a se stesso spontaneamente cade perche' cosi' la sua energia
(potenziale) diminuisce; la pallina in una roulette si ferma
spontaneamente e cosi' via.
- La situazione per i sistemi chimici e' pero' diversa. Se il
criterio della minima energia fosse l'unico valido, allora solo le
reazioni esotermiche (
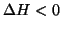 ) sarebbero spontanee. Viceversa,
esistono moltissimi esempi di reazioni e processi endotermici
(
) sarebbero spontanee. Viceversa,
esistono moltissimi esempi di reazioni e processi endotermici
(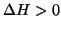 ) spontanei. Parlando della solubilita', si e' visto
che la dissoluzione di molti sali e' un processo endotermico:
) spontanei. Parlando della solubilita', si e' visto
che la dissoluzione di molti sali e' un processo endotermico:
La fusione di un pezzo di ghiaccio a 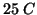 e' un altro esempio di
processo spontaneo che assorbe calore.
e' un altro esempio di
processo spontaneo che assorbe calore.
Questi e molti altri sono esempi di trasformazioni endotermiche, ma
assolutamente spontanee.
- Evidentemente, per i sistemi chimici il raggiungimento di uno
stato a minima energia non e' l'unico fattore che determina la
spontaneita' o meno di una trasformazione.
- Per comprendere meglio cio' che spinge un sistema chimico a
muoversi in una certa direzione anziche' nella direzione opposta,
consideriamo il seguente esperimento.




Next: Slide n. 372: espansione
Up: Slides delle lezioni del
Previous: Slide n. 370: solubilita'