



Next: Slide n. 373: lo
Up: Slides delle lezioni del
Previous: Slide n. 371: l'entropia;
- Ci sono due contenitori connessi da un rubinetto: in un
contenitore si trova del gas ideale, nell'altro e' stato fatto il
vuoto. Il tutto e' in condizioni adiabatiche: cioe' i contenitori sono
termicamente isolati dall'esterno.
- Tutti sappiamo che se si apre il rubinetto che connette i due
contenitori, il gas fluisce nel contenitore vuoto fino a che le
molecole che lo costituiscono sono equamente distribuite fra i due
contenitori. Tale esperimento viene detto espansione libera.
- Siccome l'esperimento si svolge in condizioni adiabatiche, non c'e'
stato ne' assorbimento ne' cessione di calore; inoltre, siccome il
secondo contenitore era inizialmente vuoto, sul gas non e' stato compiuto
alcun lavoro: l'energia del gas (
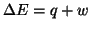 ) non e' dunque
cambiata, eppure il gas spontaneamente ha occupato il
contenitore vuoto non appena ne ha avuta la possibilita'.
) non e' dunque
cambiata, eppure il gas spontaneamente ha occupato il
contenitore vuoto non appena ne ha avuta la possibilita'.
- Cio' che ha spinto il gas ad occupare il contenitore vuoto non
e' evidentemente il raggiungimento di uno stato a piu' bassa
energia. Piuttosto, le molecole del gas tendono a disporsi nel
modo piu' disordinato possibile.
- Possiamo quindi dire che la direzione in cui si evolve un
processo e' determinata (anche) dalla ricerca di uno stato di massimo
disordine. Cio' e' dovuto, in definitiva, al fatto che le molecole che
costituiscono un sistema macroscopico si muovono in maniera del tutto
casuale.
- Tornando all'esperimento dell'espansione libera, sarebbe
veramente stupefacente se, dopo l'apertura del rubinetto, il gas
continuasse a rimanere confinato in un solo contenitore! E' del tutto
ragionevole, invece, che le molecole del gas, muovendosi completamente
a caso, finiscano per passare una meta' del loro tempo in un contenitore e
l'altra meta' nell'altro contenitore.




Next: Slide n. 373: lo
Up: Slides delle lezioni del
Previous: Slide n. 371: l'entropia;