



Next: Slide n. 321: casi
Up: Slides delle lezioni del
Previous: Slide n. 319: la
- Consideriamo allora una soluzione di
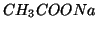 . L'acetato di
sodio e' un elettrolita forte e quindi, sciolto in acqua, si
dissociera' completamente producendo quantita' stechiometriche di ioni
. L'acetato di
sodio e' un elettrolita forte e quindi, sciolto in acqua, si
dissociera' completamente producendo quantita' stechiometriche di ioni
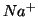 e
e 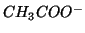 . Come abbiamo accennato, lo ione
. Come abbiamo accennato, lo ione
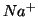 non ha caratteristiche acide e quindi non avra' tendenza a
variare il
non ha caratteristiche acide e quindi non avra' tendenza a
variare il  della soluzione. Tuttavia, lo ione acetato, come
base coniugata di un acido debole (
della soluzione. Tuttavia, lo ione acetato, come
base coniugata di un acido debole (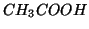 ), sara'
moderatamente forte e quindi acquistera' protoni dall'acqua secondo:
), sara'
moderatamente forte e quindi acquistera' protoni dall'acqua secondo:
- Questo equilibrio si tratta in modo identico a quanto gia' visto
per il caso del
 di una soluzione contenente una base debole: in
realta', dal punto di vista di Lowry e Brönsted, non c'e' alcuna
differenza fra i due casi!
di una soluzione contenente una base debole: in
realta', dal punto di vista di Lowry e Brönsted, non c'e' alcuna
differenza fra i due casi!
- L'unica avvertenza e' che la costante di ionizzazione basica
dello ione acetato non viene generalmente data: essa si ricava
immediatamente dalla costante di ionizzazione acida dell'acido
acetico:
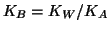 .
.
- Siccome
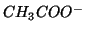 e' una base, le soluzioni di
e' una base, le soluzioni di 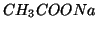 saranno basiche.
saranno basiche.
- Esempi analoghi riguardano tutte le soluzioni di sali di acidi
deboli contenenti cationi alcalini o alcalino terrosi (
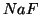 ,
,
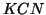 ,
, 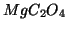 )
)
- Nei sali derivanti da acidi forti, come
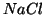 , l'anione che
si forma in seguito alla dissociazione elettrolitica, in questo caso
lo ione
, l'anione che
si forma in seguito alla dissociazione elettrolitica, in questo caso
lo ione 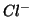 , e' una base debolissima, in quanto coniugata di
un acido forte (
, e' una base debolissima, in quanto coniugata di
un acido forte (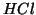 ): conseguentemente, la sua tendenza ad
acquistare protoni dall'acqua sara' trascurabile. Gli anioni
provenienti da acidi forti non danno idrolisi.
): conseguentemente, la sua tendenza ad
acquistare protoni dall'acqua sara' trascurabile. Gli anioni
provenienti da acidi forti non danno idrolisi.




Next: Slide n. 321: casi
Up: Slides delle lezioni del
Previous: Slide n. 319: la