



Next: Slide n. 319: la
Up: Slides delle lezioni del
Previous: Slide n. 317: acidi
Idrolisi.
- Col termine idrolisi si intende generalmente la
reazione per cui il
 di una soluzione varia in seguito
all'aggiunta di un sale.
di una soluzione varia in seguito
all'aggiunta di un sale.
- In realta', come vedremo, l'idrolisi non e' altro che una
reazione acido base per nulla diversa da quelle che abbiamo finora
discusso.
- Abbiamo visto che i sali sono composti ionici costituiti da un
catione proveniente da una base e da un anione proveniente da un
acido (ad esempio,
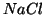 ,
, 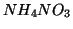 ).
).
- Alla luce della definizione di acidi e basi di Lowry e
Brönsted, possiamo dire che un sale e' costituito dall'acido
coniugato di una base e dalla base coniugata di un acido. Ad esempio,
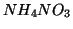 e' costituito dal catione
e' costituito dal catione 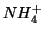 , che e' l'acido
coniugato della base
, che e' l'acido
coniugato della base 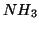 , e dall'anione
, e dall'anione 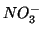 , che e'
la base coniugata dell'acido
, che e'
la base coniugata dell'acido 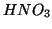 .
.
- Nota: nel caso di
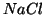 , la situazione non e' cosi' ben
definita, perche' se e' vero che
, la situazione non e' cosi' ben
definita, perche' se e' vero che 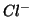 e' la base coniugata di
e' la base coniugata di
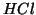 , il catione proviene da
, il catione proviene da 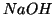 , in cui la vera base e',
secondo Lowry e Brönsted, lo ione
, in cui la vera base e',
secondo Lowry e Brönsted, lo ione 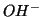 , il cui acido
coniugato e'
, il cui acido
coniugato e' 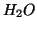 . Vedremo, tuttavia, che molti cationi
metallici, tranne quelli dei metalli alcalini e alcalino terrosi, si
comportano come degli acidi.
. Vedremo, tuttavia, che molti cationi
metallici, tranne quelli dei metalli alcalini e alcalino terrosi, si
comportano come degli acidi.
- La cosa importante e' realizzare che, in definitiva, un sale e'
costituito da due specie ioniche che hanno (o perlomeno possono avere)
carattere acido o basico; i sali sono in genere elettroliti forti e
quindi le loro soluzioni acquose contengono gli ioni da cui sono
formati. Siccome tali ioni possono cedere o acquistare protoni
dall'acqua, non stupisce che la dissoluzione di molti sali in acqua
comporti una variazione del
 .
.




Next: Slide n. 319: la
Up: Slides delle lezioni del
Previous: Slide n. 317: acidi