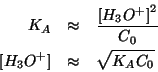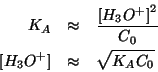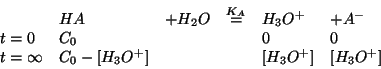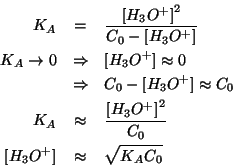Next: Slide n. 315: base
Up: Slides delle lezioni del
Previous: Slide n. 313: acido
Molto spesso, la costante di ionizzazione dell'acido debole e'
talmente piccola da consentire l'approssimazione
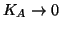 ,
vista parlando dell'equilibrio chimico in generale. In questo caso,
se si puo' assumere che la reazione in pratica non avvenga, la
concentrazione di equilibrio dell'acido risulta pari a quella
iniziale, cioe'
,
vista parlando dell'equilibrio chimico in generale. In questo caso,
se si puo' assumere che la reazione in pratica non avvenga, la
concentrazione di equilibrio dell'acido risulta pari a quella
iniziale, cioe' 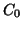 ; la concentrazione di equilibrio degli ioni
idronio si puo' poi ricavare utilizzando la legge dell'azione di massa
con il valore approssimato per la concentrazione di equilibrio
dell'acido debole:
; la concentrazione di equilibrio degli ioni
idronio si puo' poi ricavare utilizzando la legge dell'azione di massa
con il valore approssimato per la concentrazione di equilibrio
dell'acido debole:
Alternativamente: