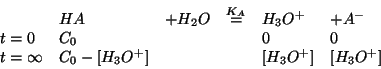Next: Slide n. 314: acido
Up: Slides delle lezioni del
Previous: Slide n. 312: base
 di una soluzione contenente un acido debole.
di una soluzione contenente un acido debole.
Sia 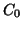 la concentrazione iniziale dell'acido
la concentrazione iniziale dell'acido 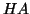 . Siccome ora
l'acido e' debole, la reazione di ionizzazione acida non sara'
completa (in questo caso, la costante di equilibrio della reazione
. Siccome ora
l'acido e' debole, la reazione di ionizzazione acida non sara'
completa (in questo caso, la costante di equilibrio della reazione
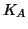 avra' un valore finito). Solo una parte dell'acido
inizialmente presente in soluzione si ionizzera' secondo l'equazione:
avra' un valore finito). Solo una parte dell'acido
inizialmente presente in soluzione si ionizzera' secondo l'equazione:
La concentrazione delle varie specie all'equilibrio va calcolata
utilizzando il metodo generale sviluppato in precedenza.
Nell'impostare la trattazione dell'equilibrio di ionizzazione la
concentrazione iniziale di ioni idronio nella soluzione si e' assunta
nulla: cio' non e' rigorosamente valido, in quanto prima dell'aggiunta
dell'acido debole, l'acqua contiene gli ioni idronio che provengono
dall'autoionizzazione. Tuttavia, come gia' osservato nel caso di un
acido forte, se i valori di 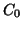 e
e 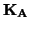 non
sono troppo piccoli, gli ioni idronio provenienti
dall'autoionizzazione dell'acqua possono essere trascurati.
non
sono troppo piccoli, gli ioni idronio provenienti
dall'autoionizzazione dell'acqua possono essere trascurati.
Inserendo le concentrazioni di equilibrio nella legge dell'azione di
massa si ottiene:
che puo' essere risolta per ottenere
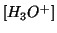 e
quindi il
e
quindi il  .
.




Next: Slide n. 314: acido
Up: Slides delle lezioni del
Previous: Slide n. 312: base