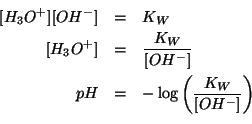E' perfettamente analogo al caso di un acido forte. Indichiamo con
sia completa, ovvero che la costante di equilibrio relativa alla reazione sia molto grande (
Da notare che abbiamo scritto una generica base forte di Lowry e Brönsted, cioe' una specie che acquista protoni dall'acqua. Nel caso la base sia un idrossido come
In entrambi i casi, come si vede, l'effetto e' quello di produrre un aumento della concentrazione di ioni ossidrile in soluzione.
In analogia a quanto visto nel caso di un acido forte, va osservato che gli ioni ossidrile in soluzione provengono sia dalla ionizzazione della base che dall'autoionizzazione dell'acqua. Tuttavia, per motivi analoghi a quelli gia' visti nel caso precedente, se
In tale ipotesi, dalla stechiometria della reazione di ionizzazione basica e dall'assunzione della sua completezza si ricava:
Infine, per il calcolo del