



Next: Slide n. 312: base
Up: Slides delle lezioni del
Previous: Slide n. 310: il
Calcoli di  .
.
Il  dell'acqua pura in condizioni di
equilibrio e' pari a
dell'acqua pura in condizioni di
equilibrio e' pari a 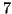 . La presenza di un acido o di una base in
soluzione acquosa modifica la concentrazione di ioni idronio e quindi
il
. La presenza di un acido o di una base in
soluzione acquosa modifica la concentrazione di ioni idronio e quindi
il  . In generale, un acido cedera' protoni all'acqua aumentando
la concentrazione di ioni idronio; viceversa, una base acquistera'
protoni dall'acqua formando ioni ossidrile e quindi diminuira' la
concentrazione degli ioni idronio.
. In generale, un acido cedera' protoni all'acqua aumentando
la concentrazione di ioni idronio; viceversa, una base acquistera'
protoni dall'acqua formando ioni ossidrile e quindi diminuira' la
concentrazione degli ioni idronio.
 di una soluzione contenente un acido forte.
di una soluzione contenente un acido forte.
Sia 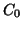 la concentrazione iniziale dell'acido
la concentrazione iniziale dell'acido 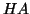 . Siccome
l'acido e' forte, esso sara' completamente dissociato. In altre
parole, si puo' assumere che la reazione di ionizzazione acida:
. Siccome
l'acido e' forte, esso sara' completamente dissociato. In altre
parole, si puo' assumere che la reazione di ionizzazione acida:
sia completa, ovvero che la costante di equilibrio relativa alla
reazione sia molto grande (
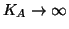 ).
).
In linea di principio, gli ioni idronio in soluzione
provengono sia dalla ionizzazione dell'acido che dall'autoionizzazione
dell'acqua. Tuttavia, se 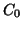 non e' molto piccola, la
concentrazione di ioni idronio proveniente dall'autoionizzazione
dell'acqua puo' essere ragionevolmente trascurata rispetto a quella
prodotta dalla ionizzazione dell'acido. Infatti, abbiamo visto che in
acqua pura si ha
non e' molto piccola, la
concentrazione di ioni idronio proveniente dall'autoionizzazione
dell'acqua puo' essere ragionevolmente trascurata rispetto a quella
prodotta dalla ionizzazione dell'acido. Infatti, abbiamo visto che in
acqua pura si ha
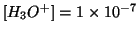 ; inoltre,
gli ioni idronio prodotti dalla ionizzazione dell'acido reprimono
l'equilibrio di autoionizzazione dell'acqua per il principio di Le
Chatelier: ne segue che in presenza dell'acido la concentrazione di
ioni idronio provenienti dall'autoionizzazione dell'acqua e' minore di
; inoltre,
gli ioni idronio prodotti dalla ionizzazione dell'acido reprimono
l'equilibrio di autoionizzazione dell'acqua per il principio di Le
Chatelier: ne segue che in presenza dell'acido la concentrazione di
ioni idronio provenienti dall'autoionizzazione dell'acqua e' minore di
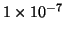 . Per
. Per
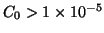 , dunque, la
concentrazione di ioni idronio provenienti dall'autoionizzazione
dell'acqua e' meno di un centesimo di quella proveniente dalla
ionizzazione dell'acido.
, dunque, la
concentrazione di ioni idronio provenienti dall'autoionizzazione
dell'acqua e' meno di un centesimo di quella proveniente dalla
ionizzazione dell'acido.
Se l'autoionizzazione dell'acqua puo' essere trascurata, il calcolo
del  e' semplicissimo: dalla stechiometria della reazione (che
si puo' assumere completa) si ricava:
e' semplicissimo: dalla stechiometria della reazione (che
si puo' assumere completa) si ricava:
e quindi: 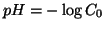




Next: Slide n. 312: base
Up: Slides delle lezioni del
Previous: Slide n. 310: il