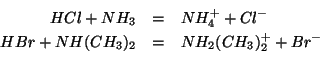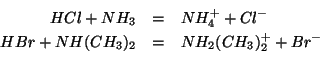Next: Slide n. 301: coppie
Up: Slides delle lezioni del
Previous: Slide n. 299: Gli
- Chiaramente, tutti gli acidi di Arrhenius sono anche acidi di
Lowry e Brönsted; inoltre, le basi tipiche di Arrhenius (gli
idrossidi) sono anche basi secondo Lowry e Brönsted nel senso che,
dissociandosi, producono ioni
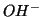 , che costituiscono la base
vera e propria secondo Lowry e Brönsted. La definizione di Lowry e
Brönsted include senza problemi anche quelle basi (come
l'ammoniaca) che non contengono gruppi ossidrilici nella formula
molecolare
, che costituiscono la base
vera e propria secondo Lowry e Brönsted. La definizione di Lowry e
Brönsted include senza problemi anche quelle basi (come
l'ammoniaca) che non contengono gruppi ossidrilici nella formula
molecolare
- Si vede subito che la definizione di Lowry e Brönsted implica
che le proprieta' acide o basiche di una determinata specie chimica non possano
essere considerate isolatamente, ma sempre in rapporto ad un'altra
specie chimica che consente alla prima di cedere o acquistare un
protone
- Ad esempio, il cloruro di idrogeno e' un acido molto forte in
soluzione acquosa, ma e' praticamente indissociato in benzene, un solvente
organico. Il motivo di cio' e' che, mentre l'acqua puo' comportarsi da
base ed acquistare il protone ceduto da
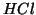 , il benzene non ha
nessuna proprieta' basica e quindi impedisce al cloruro di idrogeno di
cedere un protone.
, il benzene non ha
nessuna proprieta' basica e quindi impedisce al cloruro di idrogeno di
cedere un protone.
- In altre parole, un acido potra' comportarsi da acido solo in
presenza di un'altra specie chimica che puo' acquistare il protone da
esso ceduto, e comportarsi cosi' da base. Analogamente, una base puo'
comportarsi come tale solo in presenza di qualche specie chimica che
le possa cedere un protone, comportandosi cosi' da acido
- Abbiamo appena visto che l'acqua e' un solvente capace sia di
cedere che di acquistare protoni. Tuttavia l'acqua non e' certo
essenziale per le reazioni acido base (cosa che invece e' insita nella
definizione di Arrhenius)
- Un qualsiasi acido reagisce con qualsiasi base. Ad esempio:




Next: Slide n. 301: coppie
Up: Slides delle lezioni del
Previous: Slide n. 299: Gli