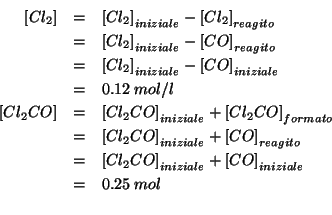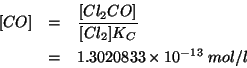Appurata la direzione in cui evolve l'equilibrio, si puo'
sfruttare il fatto che
![]() e considerare la
reazione completa. In questa ipotesi (semplificativa) si deve prima di
tutto determinare il reagente limitante: dalla semplice stechiometria
della reazione e dai valori iniziali delle concentrazioni segue che il
reagente limitante e'
e considerare la
reazione completa. In questa ipotesi (semplificativa) si deve prima di
tutto determinare il reagente limitante: dalla semplice stechiometria
della reazione e dai valori iniziali delle concentrazioni segue che il
reagente limitante e' ![]() . Quindi, ricordando quanto detto per le
reazioni complete, si puo' assumere che all'equilibrio tutto
il reagente limitante, cioe'
. Quindi, ricordando quanto detto per le
reazioni complete, si puo' assumere che all'equilibrio tutto
il reagente limitante, cioe' ![]() , verra' consumato. Per gli altri
partecipanti alla reazione, basandosi sulla stechiometria, si puo'
concludere che, all'equilibrio:
, verra' consumato. Per gli altri
partecipanti alla reazione, basandosi sulla stechiometria, si puo'
concludere che, all'equilibrio: