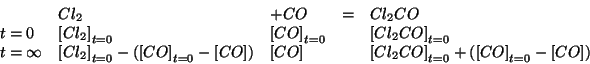Next: Slide n. 293: segue
Up: Slides delle lezioni del
Previous: Slide n. 291: segue
Un modo alternativo di procedere e' quello di impostare il
trattamento dell'equilibrio in modo generale e poi introdurre le
semplificazioni derivanti dal valore molto grande della costante di
equilibrio a livello della legge dell'azione di massa. Nel caso
presente, dopo aver appurato il verso in cui evolve l'equilibrio e
prendendo come incognita 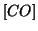 all'equilibrio, si ha:
all'equilibrio, si ha:
La legge dell'azione di massa si scrive come:
A questo punto si sfrutta il fatto che la costante di equilibrio e'
molto grande: come visto prima, la reazione si puo' considerare
completa. Sotto tale ipotesi si deve stabilire chi e' il reagente
limitante: cio' determinera' il valore approssimato della
concentrazione di equilibrio di 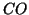 . Se il reagente limitante e'
. Se il reagente limitante e'
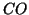 , allora la sua concentrazione di equilibrio sara' praticamente
nulla; se il reagente limitante e'
, allora la sua concentrazione di equilibrio sara' praticamente
nulla; se il reagente limitante e' 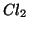 , allora la concentrazione
di equilibrio di
, allora la concentrazione
di equilibrio di 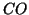 sara' pari a quella iniziale diminuita della
concentrazione iniziale di
sara' pari a quella iniziale diminuita della
concentrazione iniziale di 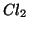 . Detto in modo piu' conciso:
. Detto in modo piu' conciso:
Come abbiamo gia' visto, si ha
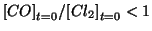 (cioe' il reagente
limitante e'
(cioe' il reagente
limitante e' 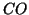 ). Quindi si puo' assumere
). Quindi si puo' assumere
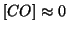 .
.
Questo valore approssimato puo' essere sfruttato per
semplificare la legge dell'azione di massa:
e quindi:




Next: Slide n. 293: segue
Up: Slides delle lezioni del
Previous: Slide n. 291: segue
![]() all'equilibrio, si ha:
all'equilibrio, si ha: