Veniamo ora alla seconda domanda: nella situazione di equilibrio
ottenuta sopra, aggiungiamo nel recipiente le ulteriori quantita' di
![]() e
e ![]() citate dall'esercizio. Chiaramente, questo significa
che l'equilibrio verra' perturbato e si spostera' di conseguenza,
secondo quanto abbiamo gia' visto. Dal punto di vista quantitativo,
si devono considerare delle nuove condizioni iniziali in cui la
concentrazione di
citate dall'esercizio. Chiaramente, questo significa
che l'equilibrio verra' perturbato e si spostera' di conseguenza,
secondo quanto abbiamo gia' visto. Dal punto di vista quantitativo,
si devono considerare delle nuove condizioni iniziali in cui la
concentrazione di ![]() e' quella appena trovata (
e' quella appena trovata (![]() ),
mentre le concentrazioni di
),
mentre le concentrazioni di ![]() e
e ![]() sono quelle di
equilibrio aumentate delle quantita' introdotte
successivamente:
sono quelle di
equilibrio aumentate delle quantita' introdotte
successivamente:
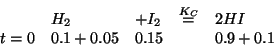
Anche in questo caso si puo' procedere in modo ``standard'', calcolando il quoziente di reazione iniziale per stabilire la direzione in cui si spostera' l'equilibrio e impostando la tabella di conseguenza.
Tuttavia, come per il primo quesito, nulla vieta di
``costruire'' delle condizioni iniziali equivalenti piu' comode. Ad
esempio, come nel caso precedente, possiamo trasformare idealmente
tutto lo ioduro di idrogeno in ![]() e
e ![]() e trattare
l'equilibrio a partire da queste condizioni iniziali.
e trattare
l'equilibrio a partire da queste condizioni iniziali.
Da queste condizioni iniziali...
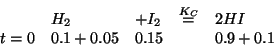
...passiamo a queste condizioni equivalenti:
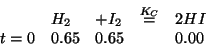
in cui non ci sono dubbi sul verso della reazione.