La costante di equilibrio per la reazione: ![]() e'
e'
![]() ad una certa temperatura. Quali saranno le concentrazioni
di equilibrio di un sistema ottenuto mescolando
ad una certa temperatura. Quali saranno le concentrazioni
di equilibrio di un sistema ottenuto mescolando ![]() di
di
![]() ,
, ![]() di
di ![]() e
e ![]() di
di ![]() in un
recipiente avente il volume di
in un
recipiente avente il volume di ![]() a quella temperatura? Se al
sistema in equilibrio aggiungiamo
a quella temperatura? Se al
sistema in equilibrio aggiungiamo ![]() di
di ![]() e
e
![]() di
di ![]() , quali saranno le nuove concentrazioni di
equilibrio?
, quali saranno le nuove concentrazioni di
equilibrio?
Il modo ``standard'' di rispondere al primo quesito lo abbiamo gia'
illustrato: si valuta il quoziente di reazione corrispondente alle
concentrazioni iniziali (che coincidono col numero di moli, dato che
il volume del recipiente e' di ![]() ), si determina cosi' il
verso della reazione e si imposta la tabella per il trattamento
dell'equilibrio.
), si determina cosi' il
verso della reazione e si imposta la tabella per il trattamento
dell'equilibrio.
Tuttavia, possiamo anche ``costruire'' delle condizioni iniziali piu'
semplici che porteranno allo stesso stato finale di equilibrio. Ad
esempio, possiamo immaginare di partire da una situazione equivalente
in cui la concentrazione iniziale di ![]() sia nulla. Come detto,
cio' si ottiene consumando idealmente tutto lo ioduro di idrogeno
posto inizialmente a reagire e producendo le corrispondenti quantita'
di
sia nulla. Come detto,
cio' si ottiene consumando idealmente tutto lo ioduro di idrogeno
posto inizialmente a reagire e producendo le corrispondenti quantita'
di ![]() e
e ![]() che si sommano a quelle gia' presenti inizialmente:
che si sommano a quelle gia' presenti inizialmente:
Da queste condizioni iniziali...
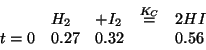
...passiamo a queste condizioni equivalenti:
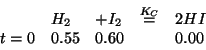
Il vantaggio e' che non c'e' da calcolare il quoziente di reazione
iniziale, poiche' il verso della reazione e' immediato: sara' quello
che porta alla formazione di un po' di ![]() .
.