



Next: Slide n. 260: equilibrio
Up: Slides delle lezioni del
Previous: Slide n. 258: un
L'equilibrio chimico.
- Finora abbiamo quasi sempre dato per scontato che una reazione
chimica converta completamente i reagenti nei prodotti.
- In realta' cio' non accade sempre e in moltissimi casi la
conversione dei reagenti nei prodotti e' incompleta. Un esempio di
questo tipo e' stato incontrato parlando degli elettroliti
deboli. Tali sostanze, in soluzione acquosa, si dissociano in ioni,
ma, a differenza degli elettroliti forti, la loro dissociazione e' solo
parziale. Ad esempio, solo il
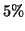 circa della quantita' di acido
acetico posta in soluzione si dissocia secondo:
circa della quantita' di acido
acetico posta in soluzione si dissocia secondo:
- L'incompletezza di moltissime reazioni chimiche si spiega con la
loro reversibilita': cioe', non solo i reagenti si trasformano in
prodotti, ma avviene anche il viceversa.
- Consideriamo ad esempio la reazione che sta alla base del
processo Haber, che rappresenta oggi il principale metodo di
produzione dell'ammoniaca:
- Se si parte da una miscela stechiometrica di
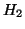 e
e 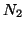 ad una certa temperatura, essi reagiranno per produrre
ammoniaca. Tuttavia, appena l'ammoniaca si forma, reagisce a sua volta
per ridare
ad una certa temperatura, essi reagiranno per produrre
ammoniaca. Tuttavia, appena l'ammoniaca si forma, reagisce a sua volta
per ridare 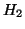 e
e 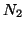 . La reazione che porta alla formazione di
ammoniaca si dice reazione diretta, mentre quella che
dall'ammoniaca riporta ai reagenti si dice reazione inversa.
. La reazione che porta alla formazione di
ammoniaca si dice reazione diretta, mentre quella che
dall'ammoniaca riporta ai reagenti si dice reazione inversa.
- All'inizio, quando la concentrazione di
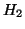 e
e 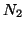 e'
alta e quella di ammoniaca e' ancora bassa, la velocita' della
reazione diretta e' maggiore di quella della reazione inversa.
e'
alta e quella di ammoniaca e' ancora bassa, la velocita' della
reazione diretta e' maggiore di quella della reazione inversa.
- Col trascorrere del tempo, tuttavia, la concentrazione dei
reagenti diminuisce e quella del prodotto aumenta: le velocita' della
reazione diretta e di quella inversa seguono ovviamente lo stesso
andamento.




Next: Slide n. 260: equilibrio
Up: Slides delle lezioni del
Previous: Slide n. 258: un