e' molto lenta poiche', procedendo in un unico stadio trimolecolare, comporta la collisione di tre ioni aventi carica dello stesso segno.
La reazione viene catalizzata da ioni ![]() . In presenza del
catalizzatore, il meccanismo della reazione cambia secondo:
. In presenza del
catalizzatore, il meccanismo della reazione cambia secondo:
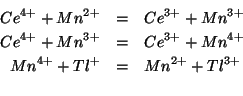
L'aumento di velocita' nel meccanismo catalizzato si spiega con la sostituzione di uno stadio trimolecolare lento con tre stadi bimolecolari piu' veloci.
Come si vede, il catalizzatore, pur intervenendo in ciascuno dei tre stadi del meccansimo catalizzato, non compare nell'equazione che descrive la reazione globale.