



Next: Slide n. 227: segue
Up: Slides delle lezioni del
Previous: Slide n. 225: l'influenza
Le proprieta' colligative.
- Alcune proprieta' delle soluzioni differiscono da quelle del
solvente puro e dipendono unicamente dalla concentrazione totale di
particelle di soluto presenti nella soluzione, ma non dalla
particolare natura del soluto: tali proprieta' vengono
generalmente chiamate proprieta' colligative.
- Abbassamento della pressione di vapore.
Si e' visto che, per un liquido puro, esiste una relazione che lega la
pressione di vapore alla temperatura (il ramo di curva che separa la
fase vapore da quella liquida nel diagramma di stato).
- Per una soluzione contenenete un soluto non volatile, la
pressione di vapore di equilibrio non dipende piu' solo dalla
temperatura, ma anche dalla concentrazione del soluto nella soluzione
(la non volatilita' del soluto assicura che la fase vapore contiene
solo molecole di solvente).
- Si trova che, per basse concentrazioni di soluto, la pressione
di vapore di molte soluzioni ad una temperatura prefissata varia in
modo approssimativamente lineare con la frazione molare del solvente:
dove 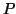 e' la pressione di vapore della soluzione,
e' la pressione di vapore della soluzione, 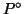 quella del solvente puro e
quella del solvente puro e
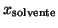 e' la frazione
molare del solvente nella soluzione. Questa relazione e' nota come
legge di Raoult e le soluzioni che la verificano sono dette
soluzioni ideali.
e' la frazione
molare del solvente nella soluzione. Questa relazione e' nota come
legge di Raoult e le soluzioni che la verificano sono dette
soluzioni ideali.
- Non tutte le soluzioni mostrano un comportamento ideale;
inoltre, il comportamento ideale e' in genere verificato solo a basse
concentrazioni.




Next: Slide n. 227: segue
Up: Slides delle lezioni del
Previous: Slide n. 225: l'influenza