



Next: Slide n. 226: le
Up: Slides delle lezioni del
Previous: Slide n. 224: soluzioni
- L'influenza della pressione sulla solubilita'.
La pressione influenza molto la solubilita' dei gas nei liquidi.
La legge di Henry quantifica l'effetto: per una miscela di gas sopra
una soluzione vale:
dove 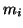 e' la molalita' del gas
e' la molalita' del gas 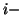 esimo nella soluzione e
esimo nella soluzione e
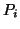 la sua pressione parziale nella fase gassosa.
la sua pressione parziale nella fase gassosa. 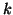 e' una
costante che dipende dalla natura della coppia soluto-solvente.
e' una
costante che dipende dalla natura della coppia soluto-solvente.
L'aumento di solubilita' con la pressione prescritto dalla legge di
Henry e' correttamente prevedibile sulla base del principio di Le Chatelier.
- L'influenza della temperatura sulla solubilita'.
Consideriamo la dissoluzione in acqua di 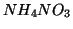 : si e' visto che
questo processo e' endotermico, cioe' avviene con assorbimento di
calore. Esso puo' quindi essere schematizzato con la seguente
equazione:
: si e' visto che
questo processo e' endotermico, cioe' avviene con assorbimento di
calore. Esso puo' quindi essere schematizzato con la seguente
equazione:
- Siccome il processo di dissoluzione avviene con assorbimento di
calore, il processo inverso avviene con sviluppo di calore.
- La domanda che ci poniamo e' la seguente: come varia la
solubilita' di
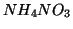 con la temperatura? Un aumento di
temperatura del sistema implica un assorbimento di calore da parte di
quest'ultimo. Siccome la dissoluzione richiede calore mentre la
riaggregazione libera calore, il principio di Le Chatelier consente di
concludere che un aumento di temperatura favorira' il processo di
dissoluzione e sfavorira' quello di riaggregazione: nel complesso,
dunque, c'e' da aspettarsi che la solubilita' aumenti con la
temperatura quando la dissoluzione e' endotermica.
con la temperatura? Un aumento di
temperatura del sistema implica un assorbimento di calore da parte di
quest'ultimo. Siccome la dissoluzione richiede calore mentre la
riaggregazione libera calore, il principio di Le Chatelier consente di
concludere che un aumento di temperatura favorira' il processo di
dissoluzione e sfavorira' quello di riaggregazione: nel complesso,
dunque, c'e' da aspettarsi che la solubilita' aumenti con la
temperatura quando la dissoluzione e' endotermica.
- In modo analogo, si deduce che un aumento di temperatura
produrra' una diminuzione di solubilita' quando il processo di
dissoluzione e' esotermico.




Next: Slide n. 226: le
Up: Slides delle lezioni del
Previous: Slide n. 224: soluzioni