



Next: Slide n. 224: soluzioni
Up: Slides delle lezioni del
Previous: Slide n. 222: un
- Abbiamo gia' accennato alla solubilita' di un soluto in un solvente
come alla massima quantita' di soluto che e' possibile sciogliere in
una data quantita' di solvente.
- Quando tale massima quantita' di soluto e' stata aggiunta al
solvente, ulteriore soluto aggiunto rimane indisciolto e si ha la
coesistenza di due fasi distinte: la soluzione e il soluto puro.
- In tali condizioni si e' raggiunto l'equilibrio (dinamico) fra
la fase solida e quella liquida e la soluzione si dice
satura. Quindi, la solubilita' di un soluto in un dato
solvente puo' essere definita in modo equivalente come la
concentrazione di soluto in una soluzione satura
- Come abbiamo gia' visto parlando dell'equilibrio liquido-vapore,
la dissoluzione di un soluto in un solvente e' determinata
dal bilancio di velocita' fra due processi che avvengono in direzioni
opposte:
Ad esempio appena mettiamo del 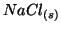 in acqua, ioni
in acqua, ioni
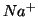 e
e 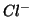 cominciano ad abbandonare il reticolo
cristallino del solido, venendo idratati dall'acqua mediante
interazioni ione-dipolo. La velocita' di questo processo e' costante e
dipende dalla temperatura. Man mano che la concentrazione di ioni in
soluzione aumenta, anche la velocita' del processo opposto a quello di
dissoluzione (cioe' il processo in cui ioni abbandonano la soluzione
per riaggregarsi alla fase solida) aumenta.
cominciano ad abbandonare il reticolo
cristallino del solido, venendo idratati dall'acqua mediante
interazioni ione-dipolo. La velocita' di questo processo e' costante e
dipende dalla temperatura. Man mano che la concentrazione di ioni in
soluzione aumenta, anche la velocita' del processo opposto a quello di
dissoluzione (cioe' il processo in cui ioni abbandonano la soluzione
per riaggregarsi alla fase solida) aumenta.
- Se si e' aggiunto sufficiente solido, la sua progressiva
dissoluzione comporta un aumento della velocita' di riaggregazione. Si
arriva cosi' al punto in cui la velocita' di riaggregazione eguaglia
quella di dissoluzione.




Next: Slide n. 224: soluzioni
Up: Slides delle lezioni del
Previous: Slide n. 222: un

