



Next: Slide n. 223: soluzioni
Up: Slides delle lezioni del
Previous: Slide n. 221: regione
Un approfondimento sulle soluzioni.
- Il processo di dissoluzione.
Quando un soluto si scioglie in un solvente, le molecole di soluto
interagiscono con le molecole di solvente tramite le forze di
interazione intermolecolari che abbiamo discusso in precedenza.
- Per molte sostanze (ad esempio
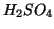 o
o 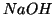 sciolti
in acqua), il processo di dissoluzione e' esotermico, cioe' libera
calore. Cio' si spiega col fatto che le interazioni soluto-solvente
sono piu' favorevoli ripetto a quelle soluto-soluto e
solvente-solvente. L'energia del sistema costituito da soluto e
solvente separati e' maggiore dell'energia della soluzione: il
processo di dissoluzione comporta una perdita di energia che si
manifesta come calore ceduto dalla soluzione all'ambiente.
sciolti
in acqua), il processo di dissoluzione e' esotermico, cioe' libera
calore. Cio' si spiega col fatto che le interazioni soluto-solvente
sono piu' favorevoli ripetto a quelle soluto-soluto e
solvente-solvente. L'energia del sistema costituito da soluto e
solvente separati e' maggiore dell'energia della soluzione: il
processo di dissoluzione comporta una perdita di energia che si
manifesta come calore ceduto dalla soluzione all'ambiente.
- Per altre sostanze (ad esempio
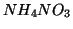 in acqua) il
processo di dissoluzione e' invece endotermico, cioe' avviene con
assorbimento di calore. In questi casi, l'energia della soluzione e'
maggiore di quella dei suoi componenti separati. Si sarebbe tentati di
pensare che un simile processo non possa avvenire spontaneamente
(cosi' come la caduta di un corpo e' spontanea, mentre nessun corpo
spontaneamente si solleva). In realta', per i sistemi chimici, il
raggiungimento di uno stato di minima energia non e' l'unico fattore
che determina la spontaneita' o meno di un processo.
in acqua) il
processo di dissoluzione e' invece endotermico, cioe' avviene con
assorbimento di calore. In questi casi, l'energia della soluzione e'
maggiore di quella dei suoi componenti separati. Si sarebbe tentati di
pensare che un simile processo non possa avvenire spontaneamente
(cosi' come la caduta di un corpo e' spontanea, mentre nessun corpo
spontaneamente si solleva). In realta', per i sistemi chimici, il
raggiungimento di uno stato di minima energia non e' l'unico fattore
che determina la spontaneita' o meno di un processo.
- Un secondo fattore che puo' risultare determinante e' la
tendenza al raggiungimento di uno stato di massimo
disordine. Ritorneremo sull'argomento con maggior dettaglio, ma per il
momento basta osservare che il processo di dissoluzione del
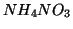 in acqua e' spontaneo, pur essendo endotermico, perche'
il disordine che si ottiene in seguito alla rottura del reticolo
cristallino del solido con formazione di ioni
in acqua e' spontaneo, pur essendo endotermico, perche'
il disordine che si ottiene in seguito alla rottura del reticolo
cristallino del solido con formazione di ioni 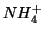 e
e
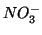 idratati in soluzione compensa ampiamente l'aumento
di energia.
idratati in soluzione compensa ampiamente l'aumento
di energia.




Next: Slide n. 223: soluzioni
Up: Slides delle lezioni del
Previous: Slide n. 221: regione