Next: Slide n. 199: legame
Up: Slides delle lezioni del
Previous: Slide n. 197: forze
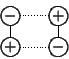
- Forze dipolo-dipolo.
Dati due dipoli elettrici, l'estremita' positiva di uno viene
attratta dall'estremita' negativa dell'altro e viceversa. Lo stesso
tipo di interazione si ha fra molecole polari.
- L'interazione dipolo-dipolo e' esotermica: cio' significa che
bisogna fornire energia per distruggere tale tipo di
interazione. Questo e' (in parte) il motivo per cui bisogna riscaldare
(cioe' fornire energia ad) un solido polare per farlo fondere o un
liquido polare per provocarne l'ebollizione.
- La temperatura di fusione o di ebollizione di un composto e'
un'indicazione di quanto intense sono le forze intermolecolari che
tengono unite le molecole nella fase solida o liquida: una
temperatura di fusione o ebollizione maggiore indica forze
intermolecolari piu' intense.
- Sulla base di cio', c'e' da aspettarsi un aumento della
temperatura di fusione o di ebollizione di un composto polare
all'aumentare del momento di dipolo risultante delle sue molecole.
- L'interazione dipolo-dipolo si puo' instaurare anche fra
molecole diverse e cio' spiega perche' alcuni composti si sciolgono in
acqua, mentre altri sono insolubili. Ad esempio, il metanolo
(
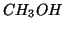 ) e' una molecola polare completamente solubile in acqua:
cio' si spiega con la favorevole interazione dipolo-dipolo che si
instaura fra le molecole di acqua e quelle di metanolo. D'altro canto,
la benzina, costituita essenzialmente da molecole organiche apolari,
e' notoriamente insolubile in acqua: le interazioni acqua-idrocarburo
sono troppo deboli per poter rendere il processo energeticamente favorito.
) e' una molecola polare completamente solubile in acqua:
cio' si spiega con la favorevole interazione dipolo-dipolo che si
instaura fra le molecole di acqua e quelle di metanolo. D'altro canto,
la benzina, costituita essenzialmente da molecole organiche apolari,
e' notoriamente insolubile in acqua: le interazioni acqua-idrocarburo
sono troppo deboli per poter rendere il processo energeticamente favorito.




Next: Slide n. 199: legame
Up: Slides delle lezioni del
Previous: Slide n. 197: forze