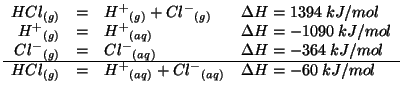Next: Slide n. 198: forze
Up: Slides delle lezioni del
Previous: Slide n. 196: segue
- Tutte le forze intermolecolari sono di natura elettrostatica.
- Forze ione-dipolo.
Sono generalmente le forze intermolecolari
piu' intense. Uno ione positivo (negativo) interagisce con una
molecola polare venendo attratto dal polo negativo (positivo) del
dipolo. L'interazione ione dipolo ha una grande importanza nelle
soluzioni. Un tipico esempio e' l'idratazione degli ioni in soluzione
acquosa.
- L'acqua e' una molecola polare e come tale interagisce con gli
ioni. Uno ione positivo verra' circondato da un certo numero di
molecole di acqua orientate con l'atomo di ossigeno (sul quale e'
localizzata una frazione di carica negativa) verso lo ione;
analogamente, uno ione negativo verra' circondato da molecole di acqua
orientate con gli atomi di idrogeno (su cui e' localizzata una
frazione di carica positiva) verso lo ione.
- Il processo di idratazione di uno ione e' generalmente
esotermico: cio' significa che l'idratazione favorisce energeticamente
un processo di dissociazione elettrolitica. Ad esempio, la rottura del
legame
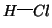 nel cloruro di
idrogeno e' un processo endotermico, che richiede un'energia di circa
nel cloruro di
idrogeno e' un processo endotermico, che richiede un'energia di circa
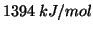 . Questo spiega come mai
. Questo spiega come mai 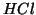 puro non e'
dissociato. Tuttavia, se si gorgoglia
puro non e'
dissociato. Tuttavia, se si gorgoglia 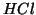 in acqua, si ha una
dissociazione completa. Cio' e' spiegato dal grande guadagno
energetico che si ha quando gli ioni
in acqua, si ha una
dissociazione completa. Cio' e' spiegato dal grande guadagno
energetico che si ha quando gli ioni 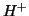 e
e 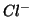 vengono
idratati:
vengono
idratati:
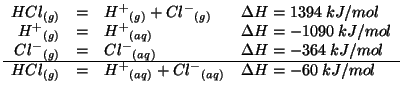




Next: Slide n. 198: forze
Up: Slides delle lezioni del
Previous: Slide n. 196: segue