Lo ione molecolaree' stato invece caratterizzato: e infatti, avendo un elettrone in meno di
, si prevede per esso un ordine di legame pari a
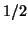
Come si vede, gli elettroni negli orbitalie
non danno alcun contributo netto al legame (
elettroni leganti e
elettroni antileganti). Cio' e' in accordo con quanto gia' visto a proposito della semplice teoria di Lewis: solo gli elettroni di valenza degli atomi vengono coinvolti nella formazione dei legami (sono quelli meno fortemente legati agli atomi); gli elettroni dei gusci interni hanno energie troppo basse (cioe' sono legati molto fortemente agli atomi)