Con la procedura generale si disegna la formula di Lewis per la molecola. Gli elettroni di valenza di ciascun atomo risultano:
L'atomo di ![]() e' circondato da
e' circondato da ![]() coppie strutturali e quindi
richiede un'ibridazione di tipo
coppie strutturali e quindi
richiede un'ibridazione di tipo ![]() , ottenuta combinando
l'orbitale
, ottenuta combinando
l'orbitale ![]() con
con ![]() dei
dei ![]() orbitali
orbitali ![]() . Rimane un
orbitale
. Rimane un
orbitale ![]() normale al piano contenente i
normale al piano contenente i ![]() orbitali ibridi.
Dalla formula di Lewis si vede che l'atomo di
orbitali ibridi.
Dalla formula di Lewis si vede che l'atomo di ![]() deve formare
deve formare ![]() legami
legami ![]() e
e ![]() legame
legame ![]() ; quindi, i
; quindi, i ![]() orbitali
ibridi e l'orbitale
orbitali
ibridi e l'orbitale ![]() puro dovranno essere semioccupati per
formare i
puro dovranno essere semioccupati per
formare i ![]() legami
legami ![]() e il legame
e il legame ![]() ,
rispettivamente.Cio' si realizza assegnando ciascuno dei
,
rispettivamente.Cio' si realizza assegnando ciascuno dei ![]() elettroni di valenza ad un orbitale diverso.
elettroni di valenza ad un orbitale diverso.
Sistemando i ![]() elettroni di valenza dell'atomo di ossigeno
secondo il principio di Pauli e la regola di Hund, si ottengono
elettroni di valenza dell'atomo di ossigeno
secondo il principio di Pauli e la regola di Hund, si ottengono ![]() orbitali
orbitali ![]() semioccupati: uno di essi avra' simmetria
semioccupati: uno di essi avra' simmetria ![]() e
sovrapporra' con un orbitale ibrido dell'atomo di carbonio;
l'altro avra' simmetria
e
sovrapporra' con un orbitale ibrido dell'atomo di carbonio;
l'altro avra' simmetria ![]() e potra' sovrapporsi all'orbitale
e potra' sovrapporsi all'orbitale
![]() puro dell'atomo di carbonio.
puro dell'atomo di carbonio.
Ciascun atomo di idrogeno possiede ![]() elettrone di valenza
che verra' sistemato nell'orbitale
elettrone di valenza
che verra' sistemato nell'orbitale ![]() , che potra' sovrapporsi con
il relativo orbitale ibrido dell'atomo di carbonio. Gli elettroni di ciascun legame vanno indicati con spin antiparallelo.
, che potra' sovrapporsi con
il relativo orbitale ibrido dell'atomo di carbonio. Gli elettroni di ciascun legame vanno indicati con spin antiparallelo.
Ne risulta uno schema come quello indicato.
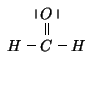
![\begin{psfrags}\psfrag{C} [c][c]{C}\psfrag{H} [c][c]{H}\psfrag{O} [c][c]{O...
...[c]{{$sp^2$}}\psfrag{p} [c][c]{{$p$}}
\includegraphics{h2co.eps}
\end{psfrags}](img859.gif)