



Next: Slide n. 136: la
Up: Slides delle lezioni del
Previous: Slide n. 134: rivisitazione
- Alla luce della teoria di Lewis e dei valori di
elettronegativita' possiamo ora razionalizzare le regole per
l'assegnazione del numero di ossidazione viste in precedenza
- L'idrogeno forma sempre e solo un legame singolo. Siccome tutti
i non metalli sono piu' elettronegativi dell'idrogeno, ne segue che il
suo numero di ossidazione sara' sempre
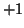 quando e'
legato a un non metallo. Al contrario, tutti i metalli sono meno
elettronegativi dell'idrogeno, che pertanto avra' numero di
ossidazione
quando e'
legato a un non metallo. Al contrario, tutti i metalli sono meno
elettronegativi dell'idrogeno, che pertanto avra' numero di
ossidazione 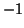 quando e' legato ad un metallo negli idruri
quando e' legato ad un metallo negli idruri
- Per soddisfare la regola dell'ottetto il fluoro forma sempre un
legame singolo. Siccome esso e' l'elemento piu' elettronegativo se ne
deduce che il suo numero di ossidazione nei composti sara' sempre
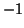
- Per soddisfare la regola dell'ottetto l'ossigeno tende a formare
sempre due legami, come in
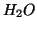 . Siccome solo il fluoro e' piu'
elettronegativo dell'ossigeno, in un composto l'ossigeno avra' quasi
sempre numero di ossidazione
. Siccome solo il fluoro e' piu'
elettronegativo dell'ossigeno, in un composto l'ossigeno avra' quasi
sempre numero di ossidazione 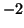 ; ovviamente questa regola non vale se
l'ossigeno e' legato al fluoro: il numero di ossidazione dell'ossigeno
nel composto
; ovviamente questa regola non vale se
l'ossigeno e' legato al fluoro: il numero di ossidazione dell'ossigeno
nel composto 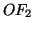 non puo' che essere
non puo' che essere 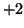 ; un'altra eccezione
si ha nei perossidi, composti in cui e' presente un legame
-
; un'altra eccezione
si ha nei perossidi, composti in cui e' presente un legame
-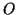 --
--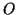 -: in questo caso la coppia di legame tra i due atomi di
ossigeno va equamente suddivisa e cio' riduce di
-: in questo caso la coppia di legame tra i due atomi di
ossigeno va equamente suddivisa e cio' riduce di 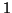 gli elettroni
formalmente acquistati da ciascuno dei due atomi di ossigeno, che
avra' pertanto numero di ossidazione
gli elettroni
formalmente acquistati da ciascuno dei due atomi di ossigeno, che
avra' pertanto numero di ossidazione 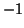
- In modo analogo a quanto appena visto si possono razionalizzare
tutte le regole viste in precedenza per l'assegnazione del numero di
ossidazione




Next: Slide n. 136: la
Up: Slides delle lezioni del
Previous: Slide n. 134: rivisitazione