- scrivere la formula di Lewis della molecola
- per ogni coppia di legame assegnare un elettrone a ciascuno dei due atomi legati
- a questo punto la carica formale di ciascun atomo e' data dalla differenza tra gli elettroni di valenza dell'atomo isolato e gli elettroni di valenza dell'atomo nella molecola
- la somma delle cariche formali di tutti gli atomi di una molecola o ione deve essere uguale alla sua carica elettrica
Esempio 48
Confrontare il numero di ossidazione e la carica atomica formale di
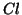 in
in 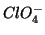 .
.