



Next: Slide n. 134: rivisitazione
Up: Slides delle lezioni del
Previous: Slide n. 132: polarita'
- La tendenza di un atomo ad attrarre gli elettroni di legame verso
di se' e' espressa quantitativamente dall'elettronegativita'
(simbolo
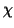 ): i valori di elettronegativita' di tutti gli
elementi sono tabulati e, come ci si puo' aspettare, il loro andamento
e' ricavabile da quello dell'energia di ionizzazione e dell'affinita'
elettronica. L'elettronegativita' cresce da sinistra a destra lungo un
periodo e diminuisce dall'alto in basso lungo un gruppo. L'elemento piu'
elettronegativo e' il fluoro, quello meno elettronegativo e' il francio.
): i valori di elettronegativita' di tutti gli
elementi sono tabulati e, come ci si puo' aspettare, il loro andamento
e' ricavabile da quello dell'energia di ionizzazione e dell'affinita'
elettronica. L'elettronegativita' cresce da sinistra a destra lungo un
periodo e diminuisce dall'alto in basso lungo un gruppo. L'elemento piu'
elettronegativo e' il fluoro, quello meno elettronegativo e' il francio.
- Dai valori di elettronegativita' degli elementi si possono fare
delle previsioni sulla polarita' dei legami che essi formano: maggiore
e' la differenza di elettronegativita' fra due atomi, e
maggiore sara' il carattere polare del legame che formano.
- Il caso limite di legame polare e' il trasferimento completo della
coppia di legame all'atomo piu' elettronegativo, con formazione di due
ioni. Il legame ionico e' dunque un caso limite del legame
covalente. Per questo motivo, spesso si parla della ``percentuale di
ionicita''' di un legame covalente, riferendosi in pratica alla sua polarita'.
- Il legame covalente fra due atomi identici (es.
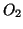 ,
,
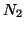 ) e' esattamente ``bilanciato'' (perche' la differenza di
elettronegativita' e' nulla): si parla in tal caso di legame covalente
puro o apolare. Da sottolineare: e' la differenza di
elettronegativita' che determina la polarita', non il suo valore
assoluto. Ad esempio, il fluoro e' l'elemento piu' elettronegativo
(elettronegativita'
) e' esattamente ``bilanciato'' (perche' la differenza di
elettronegativita' e' nulla): si parla in tal caso di legame covalente
puro o apolare. Da sottolineare: e' la differenza di
elettronegativita' che determina la polarita', non il suo valore
assoluto. Ad esempio, il fluoro e' l'elemento piu' elettronegativo
(elettronegativita' 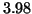 ), ma il momento di dipolo della molecola
), ma il momento di dipolo della molecola
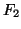 e' nullo (perche' la differenza di elettronegativita' e' nulla)
e' nullo (perche' la differenza di elettronegativita' e' nulla)




Next: Slide n. 134: rivisitazione
Up: Slides delle lezioni del
Previous: Slide n. 132: polarita'