



Next: Slide n. 133: elettronegativita'
Up: Slides delle lezioni del
Previous: Slide n. 131: l'ordine
Polarita' dei legami
- Si e' visto che atomi diversi possiedono diversi valori
dell'energia di ionizzazione (facilita' a perdere elettroni) e
dell'affinita' elettronica (facilita' ad acquistare elettroni).
- Da quanto sopra non dovrebbe stupire che se due atomi diversi si
legano con un legame chimico, gli elettroni di legame possono non essere
condivisi equamente fra i due atomi, ma la densita' elettronica puo'
risultare concentrata maggiormente verso uno di essi.
- Cio' provoca la formazione di un eccesso di carica negativa
sull'atomo verso cui la densita' elettronica e' maggiormente
sbilanciata, e un eccesso di carica positiva sull'altro atomo:
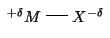 .
.
- Ci si riferisce ad un legame di questo tipo come ad un legame
polare, perche' esso contiene un polo di carica positiva e uno
di carica negativa.
- La polarita' di un legame e' espressa dal momento di
dipolo ad esso associabile. Date due cariche di segno opposto e di
modulo pari a
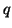 , il momento di dipolo ad esse associato e' un
vettore diretto dalla carica negativa verso quella positiva, avente
modulo pari a
, il momento di dipolo ad esse associato e' un
vettore diretto dalla carica negativa verso quella positiva, avente
modulo pari a 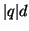 , dove
, dove 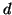 e' la distanza che separa le due
cariche.
e' la distanza che separa le due
cariche.
- Una molecola contenente uno o piu' legami polari, sara'
caratterizzata da un momento di dipolo risultante che si ottiene dalla
somma vettoriale (regola del parallelogramma) dei momenti di dipolo di
tutti i legami della molecola. Es.
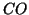 ,
, 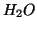 ,
, 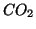 ,
,
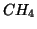 .
.




Next: Slide n. 133: elettronegativita'
Up: Slides delle lezioni del
Previous: Slide n. 131: l'ordine