



Next: Slide n. 116: il
Up: Slides delle lezioni del
Previous: Slide n. 114: il
- Con il carbonio ci si trova di fronte a due diverse possibilita'
per gli ultimi due elettroni (i primi quattro occupano ovviamente gli
orbitali
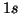 e
e 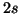 ): possiamo accoppiarli (con spin antiparalleli)
nello stesso orbitale
): possiamo accoppiarli (con spin antiparalleli)
nello stesso orbitale 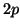 , oppure possiamo assegnare ciascuno ad un
diverso orbitale
, oppure possiamo assegnare ciascuno ad un
diverso orbitale 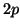 (ad esempio uno al
(ad esempio uno al 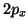 ed uno al
ed uno al
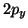 ). In realta' le due scelte non sono equivalenti, nel senso che
una produce un'energia maggiore dell'altra. Intuitivamente,
l'accoppiamento dei due elettroni nello stesso orbitale comporta
un'interazione repulsiva fra di essi, che aumenta l'energia totale del
sistema rispetto alla situazione che vede i due elettroni spaiati (cioe'
occupanti due orbitali diversi). Questo concetto e' formalizzato dalla
cosiddetta regola di Hund:
). In realta' le due scelte non sono equivalenti, nel senso che
una produce un'energia maggiore dell'altra. Intuitivamente,
l'accoppiamento dei due elettroni nello stesso orbitale comporta
un'interazione repulsiva fra di essi, che aumenta l'energia totale del
sistema rispetto alla situazione che vede i due elettroni spaiati (cioe'
occupanti due orbitali diversi). Questo concetto e' formalizzato dalla
cosiddetta regola di Hund:
La configurazione piu' stabile e' quella caratterizzata dal maggior
numero possibile di elettroni spaiati con spin parallelo
In base a cio', la configurazione elettronica del carbonio sara':
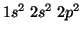 , dove e' sottinteso che i due elettroni
, dove e' sottinteso che i due elettroni 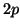 occupano orbitali diversi con spin parallelo (cioe', piu' in dettaglio,
si potrebbe scrivere
occupano orbitali diversi con spin parallelo (cioe', piu' in dettaglio,
si potrebbe scrivere
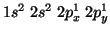 ). La notazione a
caselle e' ancora piu' esplicita:
). La notazione a
caselle e' ancora piu' esplicita:
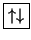
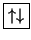


![\fbox{\raisebox{0mm}[\downarrowHeight][\downarrowDepth]{\hspace{2\downarrowWidth}}}](img723.gif)
- Negli elementi dall'azoto al neon, gli elettroni addizionali
finiscono di occupare gli orbitali
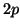 (sempre rispettando il
principio di Pauli e la regola di Hund). Il neon completa il secondo
strato elettronico (
(sempre rispettando il
principio di Pauli e la regola di Hund). Il neon completa il secondo
strato elettronico (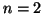 ) e termina il secondo periodo della tavola
periodica:
) e termina il secondo periodo della tavola
periodica:
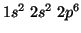 ,
,
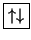
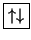
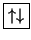
- Nel terzo periodo (
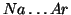 ) gli elettroni vanno ad
occupare gli orbitali
) gli elettroni vanno ad
occupare gli orbitali 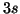 e
e 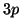 in modo analogo a quanto visto per
il periodo precedente.
in modo analogo a quanto visto per
il periodo precedente.
- Nel potassio, la destabilizzazione degli orbitali
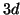 dovuta
all'effetto schermo e' tale per cui la loro energia supera quella
degli orbitali
dovuta
all'effetto schermo e' tale per cui la loro energia supera quella
degli orbitali 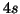 : ne segue che la configurazione elettronica del
potassio e'
: ne segue che la configurazione elettronica del
potassio e'
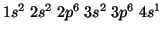 e
non
e
non
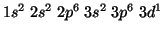 .
.




Next: Slide n. 116: il
Up: Slides delle lezioni del
Previous: Slide n. 114: il