



Next: Slide n. 115: la
Up: Slides delle lezioni del
Previous: Slide n. 113: il
- Tenendo presente il principio di Pauli, la configurazione
elettronica dello stato fondamentale di un atomo puo' essere ricavata
assegnando i suoi elettroni ai vari orbitali, a partire da quelli ad
energia piu' bassa (principio dell'``Aufbau'')
- Il primo elemento della tavola periodica e' l'idrogeno, che ha
numero atomico
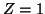 , cioe' possiede un solo elettrone. Tale elettrone
sara' assegnato all'orbitale piu' stabile, cioe' l'orbitale
, cioe' possiede un solo elettrone. Tale elettrone
sara' assegnato all'orbitale piu' stabile, cioe' l'orbitale
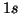 . La configurazione elettronica dell'idrogeno si indica con
. La configurazione elettronica dell'idrogeno si indica con
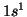 o con una notazione grafica a caselle:
o con una notazione grafica a caselle:

- L'elemento successivo all'idrogeno e' l'elio,
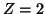 . Entrambi
gli elettroni dell'elio possono essere assegnati all'orbitale
. Entrambi
gli elettroni dell'elio possono essere assegnati all'orbitale 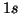 ,
con spin antiparalleli per rispettare il principio di Pauli. La
configurazione elettronica dell'elio e' cosi':
,
con spin antiparalleli per rispettare il principio di Pauli. La
configurazione elettronica dell'elio e' cosi': 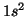 . L'elio completa
tutte le possibilita' con
. L'elio completa
tutte le possibilita' con 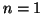 . I prossimi elettroni
(
. I prossimi elettroni
(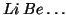 ) devono per forza avere
) devono per forza avere 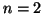 (per il principio di
Pauli).
(per il principio di
Pauli).
- Il
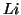 ha numero atomico
ha numero atomico 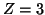 . Due dei suoi tre elettroni
andranno ad occupare l'orbitale
. Due dei suoi tre elettroni
andranno ad occupare l'orbitale 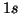 , come gia' visto per l'elio; il
terzo elettrone deve necessariamente occupare l'orbitale successivo a
piu' bassa energia disponibile. Da quanto gia' visto, tale orbitale e'
il
, come gia' visto per l'elio; il
terzo elettrone deve necessariamente occupare l'orbitale successivo a
piu' bassa energia disponibile. Da quanto gia' visto, tale orbitale e'
il 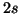 , per cui la configurazione elettronica del
, per cui la configurazione elettronica del 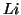 e':
e':
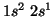 ovvero
ovvero
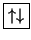

- La configurazione elettronica dell'elemento successivo (
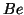 ),
sara' chiaramente
),
sara' chiaramente 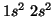 ,
,
- Un elettrone in piu' (
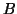 ) dovra' ora occupare un altro orbitale
(per il principio di Pauli). I livelli energetici disponibili a piu'
bassa energia sono ora quelli corrispondenti agli orbitali
) dovra' ora occupare un altro orbitale
(per il principio di Pauli). I livelli energetici disponibili a piu'
bassa energia sono ora quelli corrispondenti agli orbitali 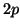 . Ci
sono tre orbitali
. Ci
sono tre orbitali 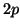 che hanno la stessa energia, ma differente
orientazione
che hanno la stessa energia, ma differente
orientazione
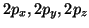 (in corrispondenza ai valori di
(in corrispondenza ai valori di
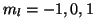 ): il quinto elettrone del boro verra' assegnato a uno
qualsiasi di essi. La configurazione elettronica del boro sara' percio':
): il quinto elettrone del boro verra' assegnato a uno
qualsiasi di essi. La configurazione elettronica del boro sara' percio':
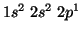 ,
,

![\fbox{\raisebox{0mm}[\downarrowHeight][\downarrowDepth]{\hspace{2\downarrowWidth}}}](img723.gif)
![\fbox{\raisebox{0mm}[\downarrowHeight][\downarrowDepth]{\hspace{2\downarrowWidth}}}](img723.gif)




Next: Slide n. 115: la
Up: Slides delle lezioni del
Previous: Slide n. 113: il