![]() si dissocia secondo:
si dissocia secondo:
![]()
Calcolare il grado di dissociazione, le frazioni molari e le pressioni
parziali di ![]() e di
e di ![]() per un sistema in cui
per un sistema in cui
![]() di
di ![]() , contenuti in un volume di
, contenuti in un volume di ![]() ,
esercitano, dopo che si e' stabilito l'equilibrio, una pressione di
,
esercitano, dopo che si e' stabilito l'equilibrio, una pressione di
![]() alla temperatura di
alla temperatura di ![]() .
.
SVOLGIMENTO
Dati:
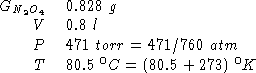
Altri simboli:

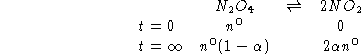
Per il numero totale di moli all'equilibrio vale:
![]()
Quindi:
![]()
da cui:

Per trovare le frazioni molari:

![]()
Infine, per trovare le pressioni parziali:

Scrivere e bilanciare in forma molecolare le seguenti reazioni redox:
SVOLGIMENTO
Il ![]() puo' ridursi unicamente a ione
puo' ridursi unicamente a ione ![]() . Quindi la
reazione non bilanciata sara':
. Quindi la
reazione non bilanciata sara':
![]()
NOTA: nelsia il Cr che lo I vengono ossidati. La cosa piu' conveniente e' quella di scrivere un'unica semireazione di ossidazione.
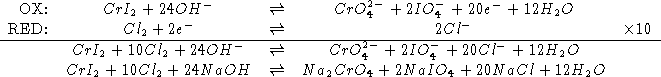
Assumendo che il Cl dello ione ![]() si riduca a ione
si riduca a ione
![]() , la reazione non bilanciata e':
, la reazione non bilanciata e':
![]()
Allora:
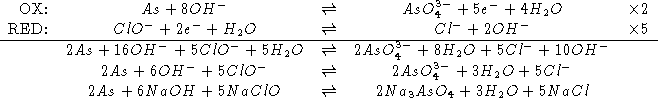
![]() di una soluzione di
di una soluzione di ![]() sono diluiti con acqua ad
un volume di
sono diluiti con acqua ad
un volume di ![]() .
. ![]() di quest'ultima soluzione sono
titolati, in ambiente acido per acido solforico, con una soluzione di
di quest'ultima soluzione sono
titolati, in ambiente acido per acido solforico, con una soluzione di
![]() , il cui volume richiesto e' di
, il cui volume richiesto e' di
![]() . Calcolare la concentrazione di acqua ossigenata nella
soluzione originaria espressa in g/l ed il volume in ml, a c.n.,
di
. Calcolare la concentrazione di acqua ossigenata nella
soluzione originaria espressa in g/l ed il volume in ml, a c.n.,
di ![]() che si sviluppa da
che si sviluppa da ![]() di quella soluzione
(
di quella soluzione
( ![]() ).
).
SVOLGIMENTO
Dati:
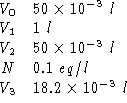
Altri simboli utilizzati:

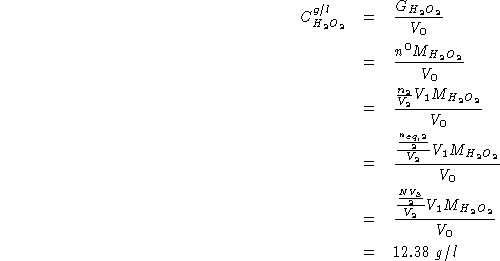
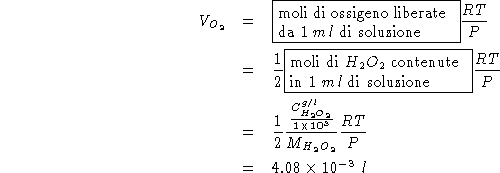
Un composto ionico ![]() si dissocia completamente in
si dissocia completamente in ![]() in
in
![]() e
e ![]() . Calcolare la pressione osmotica a
. Calcolare la pressione osmotica a ![]() di
una soluzione acquosa di
di
una soluzione acquosa di ![]() che presenta un innalzamento
ebullioscopico di
che presenta un innalzamento
ebullioscopico di ![]() . La
. La ![]() dell'
dell' ![]() e' di
e' di
![]() e la soluzione e' al
e la soluzione e' al ![]() in peso
con densita' di
in peso
con densita' di ![]() .
.
SVOLGIMENTO
Dati:
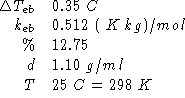
Altri simboli:

![]()
Per trovare ![]() si utilizzano i dati relativi
all'innalzamento ebullioscopico:
si utilizzano i dati relativi
all'innalzamento ebullioscopico:
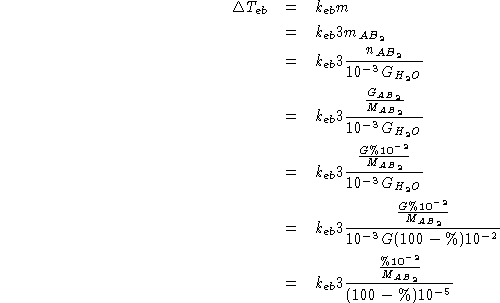
da cui:
![]()
Sostituendo in (1) si ottiene:
![]()
Avendo a disposizione soluzioni da un litro, tutte a concentrazione
![]() , di
, di ![]() , KOH,
, KOH, ![]() e
e ![]() preparare due soluzioni tampone rispettivamente a pH=4.00 e a
pH=10.00, sapendo che la costante di dissociazione per
preparare due soluzioni tampone rispettivamente a pH=4.00 e a
pH=10.00, sapendo che la costante di dissociazione per ![]() e'
e' ![]() e che la costante di dissociazione per
e che la costante di dissociazione per
![]() e'
e' ![]() .
.
SVOLGIMENTO
Dati:
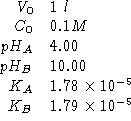
Altri simboli:

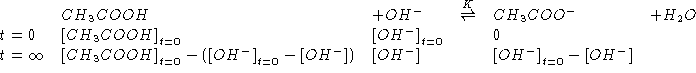
![]()
NOTA:
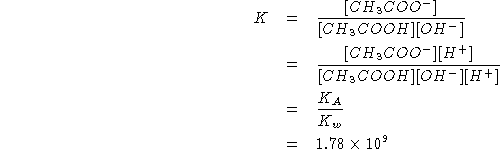
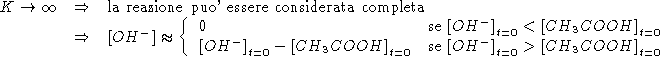
Assumendo: ![]() \
si ha:
\
si ha:
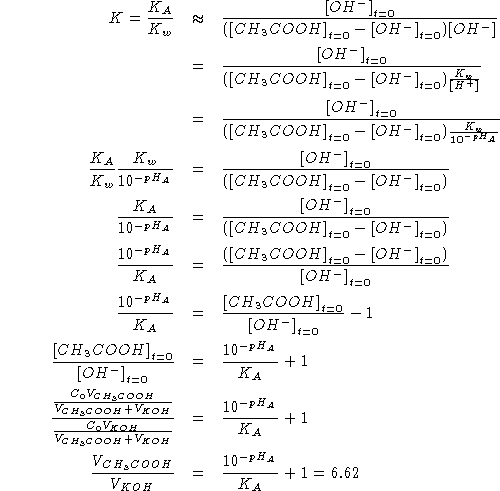
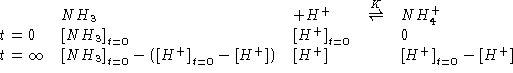
![]()
NOTA:

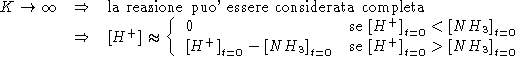
Assumendo: ![]() \
si ha:
\
si ha:
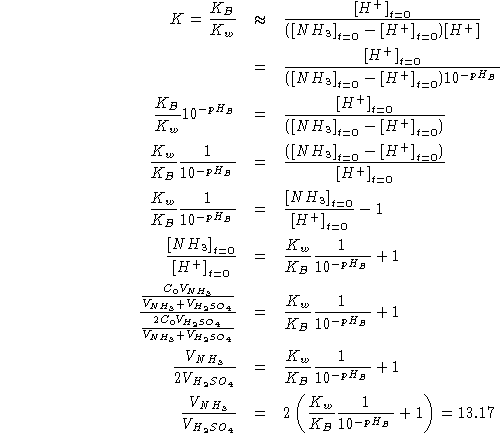
%