 |
La misura diretta del potenziale elettrodico di un singolo elettrodo non e' sperimentalmente accessibile.
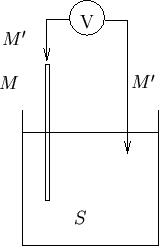
Per convincersene in modo qualitativo, si immagini di voler misurare con un voltmetro la differenza di potenziale fra una sbarretta metallica e la soluzione in cui questa e' immersa. A tale scopo, si dovrebbe collegare il primo puntale dello strumento alla sbarretta e il secondo alla soluzione (figura 1.2).
In tal modo, pero', fra il secondo puntale del voltmetro e la soluzione si avrebbe un'interfaccia del tutto analoga a quella appena discussa: in altre parole il sistema costituito dal secondo puntale del voltmetro immerso nella soluzione rappresenterebbe un secondo elettrodo, caratterizzato anch'esso da un suo potenziale elettrodico. L'insieme dei due elettrodi cosi' ottenuto costituisce una cella elettrochimica.
Conseguentemente, la differenza di potenziale misurata dal voltmetro sarebbe data da:
dove ![]() e' il metallo di cui sono costituiti i puntali del
voltmetro e si sono indicate con
e' il metallo di cui sono costituiti i puntali del
voltmetro e si sono indicate con ![]() ed
ed ![]() le
differenze di potenziale fra metallo e soluzione, cioe' i potenziali
elettrodici (si e' altresi' assunta trascurabile la differenza di
potenziale di contatto fra il puntale del voltmetro e la sbarretta
metallica: tale differenza di potenziale e' presente quando
le
differenze di potenziale fra metallo e soluzione, cioe' i potenziali
elettrodici (si e' altresi' assunta trascurabile la differenza di
potenziale di contatto fra il puntale del voltmetro e la sbarretta
metallica: tale differenza di potenziale e' presente quando ![]() ed
ed
![]() sono due metalli diversi).
sono due metalli diversi).
Da quanto detto dovrebbe risultare evidente che solo la differenza fra i potenziali elettrodici di due elettrodi accoppiati in una cella e' sperimentalmente accessibile (figura 1.3).
Nel caso piu' semplice (cioe' a meno di potenziali di giunto, vedere oltre), tale differenza di potenziale e' data, come si e' appena visto nel caso del voltmetro, da:
(si ricordi che ![]() e' il potenziale elettrodico dell'elettrodo
1 cioe':
e' il potenziale elettrodico dell'elettrodo
1 cioe':
![]() ; lo stesso vale per
; lo stesso vale per ![]() :
:
![]() )
)
Il fatto che ne' ![]() ne'
ne' ![]() siano singolarmente
accessibili, ma sia possibile misurare solo la loro differenza
suggerisce una definizione ``operativa'' di potenziale elettrodico: in
una cella come quella schematizzata in figura 1.3, si
puo' variare l'elettrodo
siano singolarmente
accessibili, ma sia possibile misurare solo la loro differenza
suggerisce una definizione ``operativa'' di potenziale elettrodico: in
una cella come quella schematizzata in figura 1.3, si
puo' variare l'elettrodo ![]() , mantenendo fisso quello
, mantenendo fisso quello ![]() ed
assegnare al potenziale elettrodico dell'elettrodo
ed
assegnare al potenziale elettrodico dell'elettrodo ![]() il valore
numerico della differenza di potenziale misurata. E' evidente che il
valore numerico assegnato in tal modo al potenziale elettrodico
dell'elettrodo
il valore
numerico della differenza di potenziale misurata. E' evidente che il
valore numerico assegnato in tal modo al potenziale elettrodico
dell'elettrodo ![]() e' arbitrario (come si e' visto, esso e' in
realta' la differenza
e' arbitrario (come si e' visto, esso e' in
realta' la differenza
![]() ): tuttavia, la
differenza fra due qualsiasi potenziali elettrodici cosi' definiti e'
identica alla differenza tra i loro valori ``assoluti''
(sperimentalmente inaccessibili):
): tuttavia, la
differenza fra due qualsiasi potenziali elettrodici cosi' definiti e'
identica alla differenza tra i loro valori ``assoluti''
(sperimentalmente inaccessibili):
Inoltre, se indichiamo con ![]() il potenziale elettrodico
``assoluto'' ( cioe' la differenza di potenziale fra metallo e
soluzione) e con
il potenziale elettrodico
``assoluto'' ( cioe' la differenza di potenziale fra metallo e
soluzione) e con ![]() quello ``relativo'' (cioe' la differenza
di potenziale misurata in una cella costituita dall'elettrodo in
questione
quello ``relativo'' (cioe' la differenza
di potenziale misurata in una cella costituita dall'elettrodo in
questione ![]() e da un elettrodo di riferimento
e da un elettrodo di riferimento ![]() ), allora, per
quanto appena visto, deve valere:
), allora, per
quanto appena visto, deve valere:
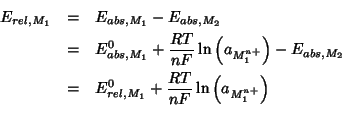
dove
![]() e' il potenziale
standard dell'elettrodo
e' il potenziale
standard dell'elettrodo ![]() ``relativo'' al riferimento
``relativo'' al riferimento ![]() .
.
Appare cosi' evidente che la legge di Nernst mantiene la sua validita' anche quando al posto del potenziale elettrodico ``assoluto'' si impieghi quello ``relativo'' appena definito. Nel seguito non si fara' percio' distinzione fra queste due grandezze, anche se la loro differenza concettuale non deve essere mai dimenticata.
Il potenziale elettrodico ![]() deve rimanere costante al variare
dei diversi partners
deve rimanere costante al variare
dei diversi partners ![]() : solo in tal modo, infatti, e' possibile
associare le variazioni della differenza di potenziale misurata
interamente alla natura di
: solo in tal modo, infatti, e' possibile
associare le variazioni della differenza di potenziale misurata
interamente alla natura di ![]() . Un elettrodo
. Un elettrodo ![]() il cui
potenziale resti costante al variare del partner a cui e' accoppiato
in una cella si chiama elettrodo di riferimento. Proprio a
causa della necessita' di avere un potenziale costante, gli elettrodi
di riferimento devono soddisfare ben precisi criteri di fabbricazione;
in particolare, la fase metallica e la soluzione in cui essa e'
immersa devono essere sempre rigorosamente le stesse (il potenziale
elettrodico dipende in prima istanza dalla natura e composizione
dell'elettrodo!). In linea di principio, qualsiasi sistema elettrodico
puo' costituire un riferimento; in pratica, tuttavia, vengono
impiegati sistemi dotati di caratteristiche particolarmente
convenienti, come elevata stabilita' del potenziale in funzione del
tempo e della temperatura, facilita' di costruzione, facile
reperibilita' dei materiali costituenti e cosi' via.
il cui
potenziale resti costante al variare del partner a cui e' accoppiato
in una cella si chiama elettrodo di riferimento. Proprio a
causa della necessita' di avere un potenziale costante, gli elettrodi
di riferimento devono soddisfare ben precisi criteri di fabbricazione;
in particolare, la fase metallica e la soluzione in cui essa e'
immersa devono essere sempre rigorosamente le stesse (il potenziale
elettrodico dipende in prima istanza dalla natura e composizione
dell'elettrodo!). In linea di principio, qualsiasi sistema elettrodico
puo' costituire un riferimento; in pratica, tuttavia, vengono
impiegati sistemi dotati di caratteristiche particolarmente
convenienti, come elevata stabilita' del potenziale in funzione del
tempo e della temperatura, facilita' di costruzione, facile
reperibilita' dei materiali costituenti e cosi' via.
Di seguito vengono brevemente descritti alcuni fra i piu' comuni elettrodi di riferimento.
L'elettrodo di riferimento rispetto a cui tutti gli altri potenziali
elettrodici vengono riportati (cioe' l'elettrodo ![]() della
discussione precedente) e' l'elettrodo standard a idrogeno (SHE) il
cui principio di funzionamento e' illustrato nella figura 1.4.
della
discussione precedente) e' l'elettrodo standard a idrogeno (SHE) il
cui principio di funzionamento e' illustrato nella figura 1.4.
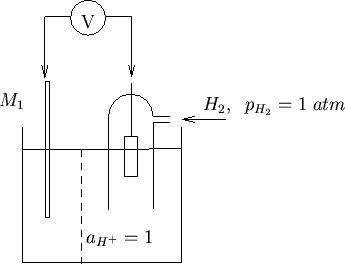 |
La reazione elettrodica e':
e il potenziale elettrodico e' dato da:
Come prima accennato, si vede che il potenziale elettrodico dipende
dalla pressione parziale di idrogeno e dall'attivita' degli ioni
![]() . Affinche' l'SHE possa essere utilizzato come riferimento,
queste due grandezze devono essere mantenute costanti. Si e' stabilito
di scegliere
. Affinche' l'SHE possa essere utilizzato come riferimento,
queste due grandezze devono essere mantenute costanti. Si e' stabilito
di scegliere
![]() . In tal modo
. In tal modo
![]() e quest'ultimo valore si assume
nullo nelle condizioni specificate.
e quest'ultimo valore si assume
nullo nelle condizioni specificate.
Sebbene l'SHE sia il riferimento primario, esso e' per lo meno scomodo da usare in pratica. Sono quindi piu' comuni altri elettrodi di riferimento rispetto ai quali i potenziali elettrodici vengono misurati.
Osserviamo che e' sempre possibile riferire all'SHE un potenziale misurato rispetto ad un altro riferimento, conoscendo il potenziale di quest'ultimo rispetto all'SHE. Se indichiamo con:
| il potenziale elettrodico ``assoluto'' di un certo elettrodo | |
| il potenziale elettrodico ``assoluto'' di un riferimento qualsiasi | |
| il potenziale elettrodico ``assoluto'' dell'SHE | |
| il potenziale ``relativo'' dell'elettrodo misurato rispetto al riferimento qualsiasi | |
| il potenziale ``relativo'' dell'elettrodo misurato rispetto all'SHE | |
| il potenziale ``relativo'' dell'elettrodo di riferimento qualsiasi rispetto all'SHE |
allora:
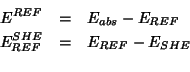
e quindi:
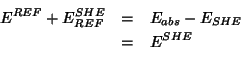
Un elettrodo di riferimento di vasto impiego pratico e' l'elettrodo a calomelano saturo (SCE), il cui schema e' mostrato nella figura 1.5.
La reazione elettrodica e la corrispondente forma della legge di Nernst sono:
Una volta fissata l'attivita' degli ioni ![]() , il potenziale dell'SCE
e' costante (si noti che l'attivita' del calomelano e del mercurio
sono sempre costanti). Il potenziale di questo elettrodo rispetto
all'SHE e' di
, il potenziale dell'SCE
e' costante (si noti che l'attivita' del calomelano e del mercurio
sono sempre costanti). Il potenziale di questo elettrodo rispetto
all'SHE e' di ![]() . Oltre alla versione satura, vengono usate altre
varianti in cui la concentrazione degli ioni
. Oltre alla versione satura, vengono usate altre
varianti in cui la concentrazione degli ioni ![]() e' fissata a
e' fissata a ![]() ,
, ![]() etc.
etc.
Un altro elettrodo di riferimento molto usato e' quello ad argento cloruro/argento, schematizzato nella figura 1.6
La reazione elettrodica e la corrispondente forma della legge di Nernst sono:
e anche in questo caso il potenziale e' fissato dall'attivita' degli
ioni cloruro. Il potenziale di questo elettrodo rispetto
all'SHE e' di ![]() .
.