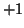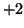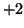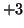Next: Slide n. 69: esempi
Up: Slides delle lezioni del
Previous: Slide n. 67: il
- Per casi piu' complessi il numero di ossidazione puo' essere
assegnato sulla base di una serie di regole, che saranno
razionalizzate in seguito alla luce delle teorie sul legame chimico
(per compattezza, sono riportate anche le due regole viste prima)
- il numero di ossidazione di un elemento e' sempre
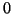 . Es:
. Es:
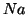 ,
, 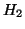 ,
, 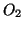 ,
, 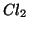
- il numero di ossidazione di uno ione e' uguale alla sua carica netta. Es:
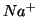 ,
, 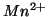 ,
, 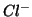 ,
, 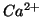
- il numero di ossidazione dell'idrogeno e' sempre
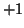 , tranne negli
idruri (composti binari idrogeno-metallo), in cui e'
, tranne negli
idruri (composti binari idrogeno-metallo), in cui e' 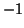
- il numero di ossidazione dell'ossigeno e' sempre
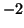 , tranne nei
perossidi (contenenti il gruppo
, tranne nei
perossidi (contenenti il gruppo 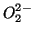 ) in cui e'
) in cui e' 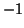 , nei
superossidi (contenenti il gruppo
, nei
superossidi (contenenti il gruppo 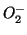 ) in cui e'
) in cui e' 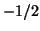 , e nel
composto
, e nel
composto 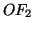 , in cui e'
, in cui e' 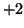
- il numero di ossidazione del fluoro e' sempre
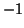
- il numero di ossidazione del cloro e' sempre
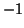 , tranne quando e'
legato al fluoro e all'ossigeno
, tranne quando e'
legato al fluoro e all'ossigeno
- il numero di ossidazione del bromo e' sempre
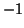 , tranne quando e'
legato al fluoro, al cloro e all'ossigeno
, tranne quando e'
legato al fluoro, al cloro e all'ossigeno
- il numero di ossidazione degli atomi metallici nei composti con altri
elementi e' sempre positivo. In particolare:
| metalli alcalini |
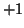 |
| metalli alcalino-terrosi |
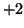 |
| zinco, cadmio |
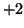 |
| boro, alluminio |
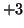 |
- la somma algebrica dei numeri di ossidazione degli elementi
costituenti una data specie chimica (ione o molecola) deve essere
uguale alla carica netta della specie stessa




Next: Slide n. 69: esempi
Up: Slides delle lezioni del
Previous: Slide n. 67: il
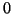 . Es:
. Es:
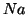 ,
, 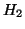 ,
, 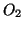 ,
, 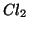
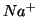 ,
, 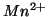 ,
, 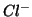 ,
, 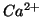
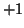 , tranne negli
idruri (composti binari idrogeno-metallo), in cui e'
, tranne negli
idruri (composti binari idrogeno-metallo), in cui e' 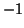
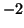 , tranne nei
perossidi (contenenti il gruppo
, tranne nei
perossidi (contenenti il gruppo 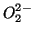 ) in cui e'
) in cui e' 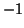 , nei
superossidi (contenenti il gruppo
, nei
superossidi (contenenti il gruppo 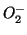 ) in cui e'
) in cui e' 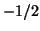 , e nel
composto
, e nel
composto 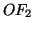 , in cui e'
, in cui e' 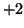
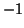
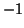 , tranne quando e'
legato al fluoro e all'ossigeno
, tranne quando e'
legato al fluoro e all'ossigeno
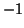 , tranne quando e'
legato al fluoro, al cloro e all'ossigeno
, tranne quando e'
legato al fluoro, al cloro e all'ossigeno